Inscription / Connexion Nouveau Sujet
Diagramme d'orbitale moléculaire
Bonjour à tous !
Alors voilà je fais un peu de chimie et j'essaie de comprendre comment se construit un diagramme d'orbitale moléculaire j'y arrive doucement mais surement.
Et pour savoir si j'ai bien compris je suis partie faire un exo que voici :
Les énergies des orbitales atomiques de valence du fluor F et du chlore Cl sont :
2s(F) = - 37,8 eV, 2p(F) = -17,4 eV et 3s(Cl) = -24,6 eV , 3p(Cl) = -13,0 eV
Dessiner le diagramme énergétique des orbitales moléculaires de la molécule ClF.
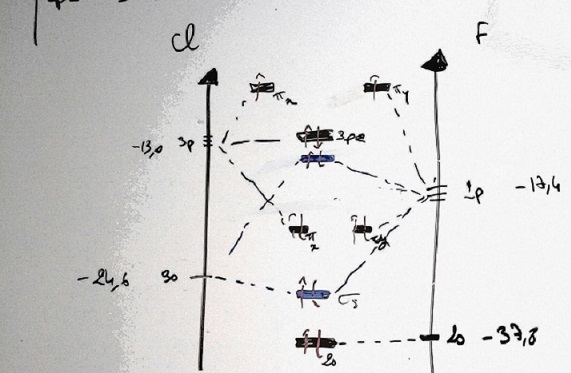
Si vous avez une correction à faire dîtes le moi et de même si c'est correcte 
Merci par avance !
Là la réponse est loin d'être évidente avec les seules données dont on dispose. Le calcul d'orbitales moléculaires à partir des orbitales atomiques n'est pas trivial. Et la différence entre les niveaux d'énergies des orbitales n'est pas le seul critère.
L"exo proposé est donc vraiment très approximatif...
Il existe un logiciel libre appelé ArgusLab, téléchargeable, qui donne les niveaux des OM pour pas mal de molécules, en utilisant des techniques semi-empiriques de calcul en chimie quantique (théorie de Huckel, PM3...)
En le faisant tourner on n'obtient pas tout à fait votre schéma :
l'OM la + basse fait intervenir la 2s et la 2p du fluor et la 3 s du Cl, bien en-dessous du niveau de la 2s du F (à 54 eV). La seconde à environ -21 eV combine la 2s de F et 3px du Cl. A priori, on aurait 2 OM de type  (plutôt s a priori). Ensuite 2px avec 3px (donc OM de type
(plutôt s a priori). Ensuite 2px avec 3px (donc OM de type  p), puis viennent 2 OM dégénérées (même énergie) : 2pz et 3pz ; 2py et 3py donc 2 OM
p), puis viennent 2 OM dégénérées (même énergie) : 2pz et 3pz ; 2py et 3py donc 2 OM  y et
y et  z. Elles sont de tyoe liante car leur énergie est à 16,5 eV.
z. Elles sont de tyoe liante car leur énergie est à 16,5 eV.
Pour finir on a à 11 eV 2 OM dégénérées anti-liantes entre 2 py et 3py et entre 2pz et 3pz. On finit avec une OM entre 2px et 3px.
J'espère ne pas avoir été trop confus dans mes explications.
Tout d'abord merci pour votre réponse ! 
L"exo proposé est donc vraiment très approximatif...
En effet le jour au j'aurais à faire ce type d'exercice j'aurais une feuille un crayon et 2 min de mon temps maxi ça explique qu'il est simplifié à son maximum.
la + basse fait intervenir la 2s et la 2p du fluor et la 3 s du Cl,
Jamais entendu parler d'une OM qui fait intervenir 3 OA ...
La seconde à environ -21 eV combine la 2s de F et 3px du Cl.
Et on m'a dis qu'une s n'irai jamais avec une px
ça peut être dut à des approximations faite par le prof mais comme je suis en PACES j'apprends seulement ce que le prof veut bien m'apprendre

Donc voici les propositions que j'ai pour répondre à la question posée :
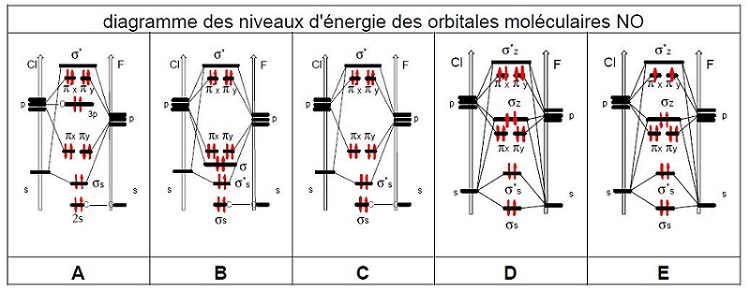
Selon vous si il y en a une de juste quelle serait elle ?
Pour ma part par élimination je trouve la A mais elle diffère de mon schéma j'aimerais savoir pourquoi..
J'ai du mal à comprendre comment on peut vous faire travailler là-dessus en paces, alors que ça requiert des connaissance en atomistique et chimie quantique vues en L2 et L3 au minimum, surtout sur une molécule hétéronucléaire !!
Une orbitale s peut très bien se recouvrir avec une orbitale p, il suffit que l'orbitale p soit dans l'axe de la liaison (pour moi c'était px par la liaison de ClF est selon x dans mon cas). Il y aura un recouvrement nul (en fait + et -) avec une orbitale p perpendiculaire à la liaison, dans mon cas avec py ou pz. Si la liaison est selon z, alors le recouvrement n'est effectivement possible qu'avec une pz.


