Inscription / Connexion Nouveau Sujet
Diagramme d'énergie molécule
Bonjour,
J'ai un petit problème sur cet exo que j'ai trouvé sur la construction de diagramme d'énergie.
On nous demande de construire le plus exactement possible Le diagramme d'énergie de la molécule SiS, AlS, KF, NeF, GeS
Avec,
Z(Si)=14, E3s=-13,5 eV, E3p=-8,20 eV
Z(Al)=13, E3s=-10,6 eV , E3p=-6,0 eV
Z(Ge)=32, E4s=-14,3 eV, E
4p=-7,9 eV
Z(K)=19, E4s=-4,4 eV
Z(Ne)=10, E2s=-47,7 eV, E2p=-21,6 eV
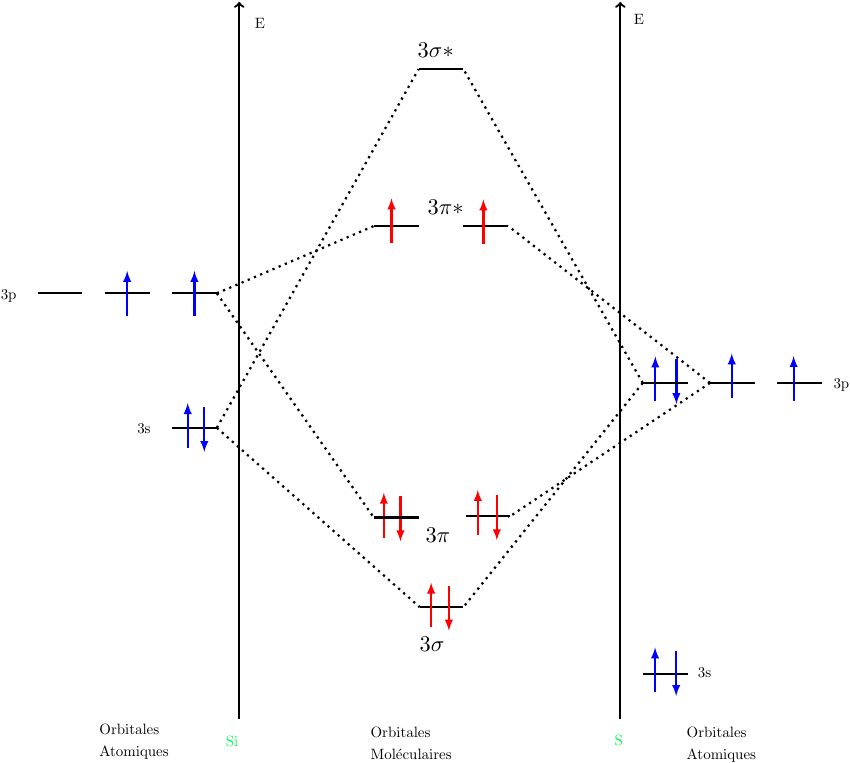
Je commence par SiS.
Si a pour structure de valence: 3s23p2 et S:3s23p4
En faisant la difference des energies, on voit que:
Les deux 3s peuvent se combiner, de même pour 3s de Si et 3pzde S et les 3px et 3py.
J'ai privilégie la combinaison de 3s de Si et 3p de S par rapport aux deux 3s car difference est moindre.
Voilà ensuite ce que j'ai obtenu. Je sais que c'est plein de fautes mais je suis favorable à toutes corrections.
Merci dav.
Bonjour
J'ai privilégie la combinaison de 3s de Si et 3p de S par rapport aux deux 3s car difference est moindre.
Possible mais cela ne correspond pas au schéma que tu as fourni. Les énergies des différentes orbitales atomiques de S sont-elles fournies par l'énoncé ?
Bonjour,
Compte tenue des énergies des différents niveaux atomiques, d'accord avec ton diagramme des O.M.
Pas d'accord avec leurs occupations.
Les orbitales 3s de Si et 3s de S conduisent à  et
et  * occupées par 4 électrons en tout : 2 sur
* occupées par 4 électrons en tout : 2 sur  , 2 sur
, 2 sur  *.
*.
Reste à placer 4 électrons sur les deux orbitales  liantes.
liantes.
Cela conduit à un indice de liaison égal à 2.
Pourquoi les orbitales 3s de Si et S se conduisent-ils? Je croyais que c'etait le 3s de Si et 3p de S qui se conduisaient.
Pourquoi les orbitales 3s de Si et S se conduisent-ils?
Attention au vocabulaire : il s'agit de combinaisons linéaires d'orbitales atomiques pour former des orbitales moléculaires
Comme déjà dit , ta construction du diagramme est correcte. Vérification faite, ta répartition des électrons est également correcte. Désolé si je t'ai un peu perturbé.