Inscription / Connexion Nouveau Sujet
Cycle thermodynamique
Bonsoir, j'ai un exercice et j'aimerais savoir si je suis sur la bonne voie 
L'enthalpie standard de la formation du bromure d'iode gazeux IBr est de 41,2 kJ/mol à 25°C
1. Calculer, au moyen des données ci après, l'enthalpie de la réaction suivante à 114°C
I2(g)+Br2(g)-> 2IBr(g)
Données :
- Capacités calorifiques molaires : Br2(l) = 71,9 ; Br2(gz)=32,6; I2 (s) =55,6; I-Br(g)=32,6, (en J/mol)
- Les états standards à 25°C sont : pour le diiode l'état solide et pour le dibrome l'état liquide.
-Enthalpie de vaporisation du dibrome : 30,1 kJ/mol à 59°C
- Enthalpie de sublimation de diiode : 62,3 kJ/mol à 114°C
Ce que j'ai fait :
I2(g)+Br2(g)-> 2IBr(g) 114°C (enthalpie standard de réaction DrH°)
Donc loi de Hess :
à 114°C : DrH°=2DfH°(IBr(g))-DfH°(I2(g))-DfH°(Br2(g))
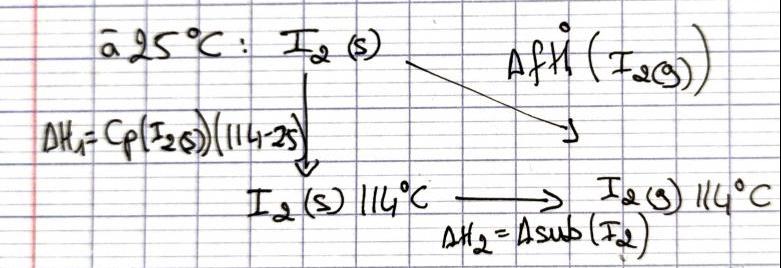
Cherchons DfH°(I2(g)) 114°C :
En partant des états standards du diiode
j'ai fais un cycle de hess (voir photo)
DfH°(I2(g))=DH1+DH2=Cp(I2(g))(114-25)+DsubH°(I2)
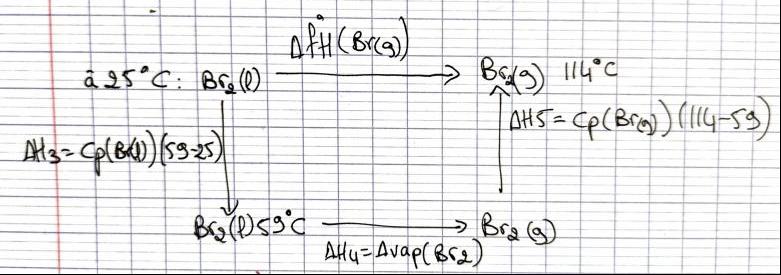
Cherchons DfH°(Br2(g)) :
voir photo
DfH°(Br2(g))= DH3+DH4+DH5 = Cp(Br(l))(59-25)+DvapH°(Br2)+Cp(Br(g))(114-59)
Cherchons DfH°(IBr) à 114°C :
2IBr (25°C)------(DrH'°)--------> 2IBr(114°C)
loi de Hess :
DrH'°=D°fH(Ibr(g))114°C)-Df°H(IBr(g)25°C)=2Cp(IBr)(114-25) (car on chauffe 25°C-> 114°C)
<=> Df°H(IBr 114°C)=2Cp(I-Br)(114-25)+DfH°(IBr)25°C
et donc j'ai trouvé les différents DfH° à la bonne température puis j'ai plus qu'à calculer DrH° 114°C de ma réaction
DrH°=-7580,4J/mol (sauf erreur)
voila, j'aimerais savoir si j'ai bien fait ?
parce que mon professeur a pris un chemin inverse ;
il est directement parti de l'équation I2(g)+Br2(g)-> 2IBr(g)
puis a fait une cascade de transformation des deux réactifs pour arriver à leurs états standards à 25°C puis a refermé son cycle en chauffant le tout :
I2(g)+Br2(g)=2IBr(g) 114°C----------etc-----> I2(s)+Br2(l)------(2Dr°H(IBr(g)) 25°C-------->2Ibr(g))------------->referme son cycle (2Cp(IBr(g)(114-59)=2IBr(g) 114°C
Je ne comprends pas pourquoi passer de 114°C et état gazeux pour mettre les réactifs à 25°C à leur état standard (solide et liquide) puis qui donne IBr(g) et le rechauffe à 114°C
Là, je ne comprends pas, comment est ce qu'il a su que I2 solide et Br2 liquide donnerait du IBr gaz ? (en rouge) sinon je serais directement passé par cette démarche
Merci beaucoup
Bonsoir
Il s'agit là d'une application à un cas particulier de la première loi de Kirchhoff sur l'influence de la température sur une enthalpie standard de réaction. La méthode générale consiste à envisager deux chemins différents :
chemin 1 : chemin direct de la réaction avec réactifs et produit à 114°C
chemin 2 : passage des réactifs à 25°C en tenant compte des changement d'états physiques éventuels puis réaction à 25°C puis réchauffement des produits de 25°C à 114°C en tenant compte des changements d'états physiques éventuels.
On écrit alors que, pour un avancement d'une mole, la variation d'enthalpie est la même par les deux chemins différents puisque l'enthalpie est une fonction d'état.
Il s'agit de la méthode la plus simple.
Bonsoir merci pour cette réponse,
j'ai effectivement pensé aux deux méthodes : mais en prévoyant l'avancée de la méthode du prof, j'étais bloqué par ce que pourraient me donné les deux réactifs à leur état standard à 25°C
Je m'explique :
J'avais voulu partir directement de l'équation et faire des cascades de réactions en tenant compte des changements d'états. Mais quand je faisais passer les réactifs à leur état standard à 25°C, je ne savais pas quel produit allaient ils donner à cet état là. ( le professeur a mis IBr gaz 25°C mais je ne savais pas et je ne sais toujours pas pourquoi ca fait ceci )
d'ailleurs est ce que du coup mon travail est exact ou y a t il des erreurs voire la démarche est fausse ?
meerci bcp 
A mon avis, l'énoncé aurait sans doute dû préciser explicitement que l'état standard à 25°C de IBr est l'état de gaz. On peut cependant parvenir à cette conclusion sans cette précision puisque l'énoncé ne fournit aucune donnée sur les enthalpies de changement d'état physique pour IBr alors qu'il en fournit sur les changements d'état de I2 et Br2.
Ta méthode semble correcte mais est plus longue à expliquer...Elle aussi suppose l'absence de changement d'état physique de IBr. La méthode la plus rapide est celle expliquée dans mon premier message, méthode apparemment utilisée par ton professeur.
Bonjour, d'accord merci par contre je trouve un résultat numérique différent comparé à celui de la correction
je refais mon calcul numérique si je me suis pas trompé
alors j'ai calculé -7580,4 J/mol
et la correction a marqué -13,4 kJ/mol
mais je suis allé un peu vite dans mon application donc je vais le refaire
J'obtiens :  rH°(114)=-13,38kJ/mol qu'il convient d'arrondir à -13,4kJ/mol comme l'as fait ton corrigé. Il y a, à mon avis, deux pièges à éviter dans ce calcul :
rH°(114)=-13,38kJ/mol qu'il convient d'arrondir à -13,4kJ/mol comme l'as fait ton corrigé. Il y a, à mon avis, deux pièges à éviter dans ce calcul :
1° : le grand "classique" : ne pas mélanger J/mol avec kJ/mol
2° : bien voir que la réaction étudiée correspond à la formation de deux moles de IBr. L'enthalpie standard de la réaction étudiée à 25°C est ainsi : 82,4kJ/mol.


