Inscription / Connexion Nouveau Sujet
courbe de dosage
Bonjour,
Tout d'abord voici l'exercice en question :
on donne la courbe du dosage ph metrique de V=10mL de H2SO3 à 0,10mol.L-1 par une solution de soude à 0,10 mol.l-1. On réalise le même dosage en ajoutant 2*10-3mol de nitrate d'argent (AgNO3 sel soluble) dans la solution de H2SO3.Connaissant pKs(Ag2SO3(s))=13,8 prévoir l'allure de la nouvelle courbe de dosage, à superposeer à la première.
Etant assez mauvais en chimie pouvez vous m'indiquer d'où commencer, en sachant que je ne sais pas utilisé le pks. En fait c'est lorsqu'ils s'agit d'utiliser la solubilité que je sais pas quoi faire. En plus j'ai la mauvaise impression que l'exercice est simple normalement mais pas pour moi apparemment.
Merci d'avance.
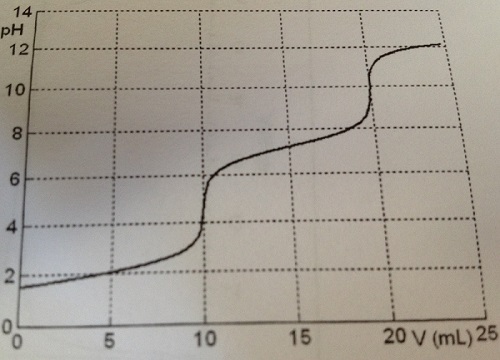
Tu as la courbe de titrage et tu peux donc déterminer les pK1 et pK2 du diacide H2SO3. Tu connais aussi le pH initial et tu peux donc déterminer la concentration en SO3 2- initialement
Tu vas alors constater que la concentration en SO3 2-( qui est petite , la solution contient essentiellement H2SO3) est suffisante pour précipiter avec les Ag+ ajooutés ...
Donc on fait la réaction H2SO3 +2Ag+ -> Ag2SO3 solide +2H+
Tu vois alors ce qu'il y a dans la solution et ce qui peut se passer quand on y ajoute des OH- ...


