Inscription / Connexion Nouveau Sujet
Constante d'acidité
Bonjour.
Je bloque sur une question d'un exercice de chimie donc voici le sujet.
On étudie le paranitrophénol, acide faible noté BH de pKA proche de 7. On part de 10 mL d'une solution de concentration de 10-4 mol/L et l'on fait varier le pH par ajout d'une solution d'hydroxyde de sodium de concentration 10-2 mol/L (on néglige la dilution). On suit la réaction par spectrophotométrie UV-visible. (Je joins les courbes obtenues pour différentes valeurs de pH.)
On y observe deux maxima d'absorption, à 310 nm pour BH et à 390 nm pour B-
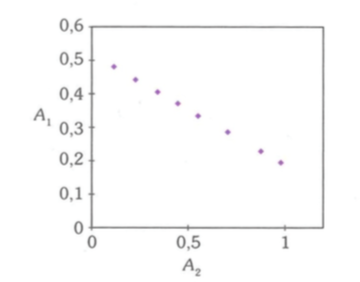
On considère également un graphe (que je joins également) présentant la variation de l'absorbante A1 à 310 nm en fonction de celle A2 à 390 nm.
Soit ei,BH et ei,B- les coefficients d'absorption molaire de BH et de B à une longueur d'onde  i.
i.
a) Calculer Ai l'absorbance à cette longueur d'onde.
b) Montrer alors que la relation : A1(e2,B--e2,BH)=A2(e1,B--e1,BH)-L*Ca(e1,B-*e2,BH-e1,BH*e2,B-) est valable pour toute valeur de pH.
c) Comparer avec les données expérimentales.
Bon, je bloque partout ! J'ai quand même utilisé les points afin d'en déduire une relation entre A1 et A2 : A1 = -1/3*A2+0,51 mais je ne sais pas si elle est utile.
D'autre part, j'essaie, sans succès, d'exploiter la relation e = A/(C*L) avec C la concentration de l'espèce et L, l'épaisseur de la cuve.
Un grand merci par avance pour vos réponses 
Bonjour
Juste une indication : si on néglige la dilution la somme des concentrations
[BH]+[B-]
reste fixe au cours du dosage...
Pour le reste : où sont les courbes ?
Je n'ai pas trouvé d'astuce particulière ; il faut donc a priori calculer...
L'expression générale de l'absorbance à la longueur d'onde n°i, demandée question a), est :
Tu peux alors exprimer A1 et A2 puis les quatre grandeurs :
Calcule ensuite la différence :
Sachant que, comme indiqué précédemment : , tu obtiens le résultat demandé.
Du coup, les courbes ne me sont pas utiles ?
Utiles pour la question c) où il faut comparer résultats théoriques et expérimentaux.
Dans ce cas, je peux utiliser la droite passant par les points de la courbe 2 : je reprends la relation que j'avais écrite
A1+1/3*A2=0,51
Dois-je alors identifier les paramètres ?
Si oui, j'aurais :
e2,B--e2,BH=1
e1,B--e1,BH=-1/3
De plus Ca=[B-]+[BH]
Or je ne sais pas trop comment m'en sortir numériquement avec les concentrations.
La question c) me semble assez imprécise... Peut-être s'agit-il simplement de faire la remarque suivante : la relation théorique établie à la question b) prévoit A1 fonction affine de A2 : cela est bien en accord avec le second graphe.
Pour aller plus loin et tenter d'identifier :
tu connais sûrement la notion de domaines de prédominance pour un couple (acide/base) ; puisque pKa voisin de 7 :
à pH=9 : [B-] Ca ; [BH]
Ca ; [BH] 0 ; cela donne d'après les courbes :
0 ; cela donne d'après les courbes :
Il faudrait maintenant des mesures à un pH nettement inférieur à pKa pour pouvoir poser : [B-] 0 ; [BH]
0 ; [BH] Ca
Ca
La valeur pH = 6 me paraît un peu forte... Enfin en grossière approximation :
En reportant dans l'expression obtenue en b), on obtient :
0,91.A1+0,30.A2=0,44
En divisant tous les termes par 0,91 pour obtenir un coefficient égal à 1 pour A1, cela donne :
A1+0,33.A2=0,48
L'accord n'est pas si mauvais que cela, il aurait sûrement été meilleur si la courbe A=f( ) avait été tracé à un pH plus faible (4 par exemple...)
) avait été tracé à un pH plus faible (4 par exemple...)
D'accord, je comprends mieux.
Enfin, j'ai une dernière question : je suis censée trouver une relation linéaire entre le pH et la fonction f=log((A1-L*e1,BH*Ca)/(L*e1,B-*Ca-A1)
Or je ne comprends pas pourquoi on ne doit pas faire intervenir A2 ni comment je peux trouver cette relation en fonction de l'expression précédente.
Après de nombreux calculs, je trouve :
Et par suite, pH=pKa+f.
J'obtiens bien une relation entre les deux mais elle n'est pas vraiment linéaire !
Enfin, j'ai une dernière question : je suis censée trouver une relation linéaire entre le pH et la fonction f=log((A1-L*e1,BH*Ca)/(L*e1,B-*Ca-A1)

C'était la question, effectivement la relation obtenue est affine.
C'était la question, effectivement la relation obtenue est affine.
La confusion est fréquente en sciences physiques... Dès que la courbe d'équation y = f(x) est une droite, de nombreux chimistes et physiciens parlent de fonction linéaire sans faire la différence entre linéaire et affine...
Au fait, pourquoi n'avoir pas simplement fait un dosage pH-métrique ? Je ne comprends pas vraiment les avantages de là spectrophotomètre, mis à part le fait que la méthode soit non destructive, on multiplie les chances de faire des erreurs de mesure, non ?
Au fait, pourquoi n'avoir pas simplement fait un dosage pH-métrique ?
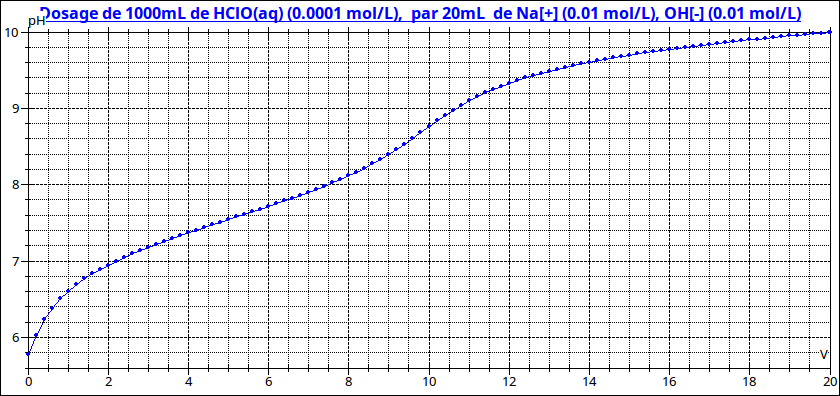
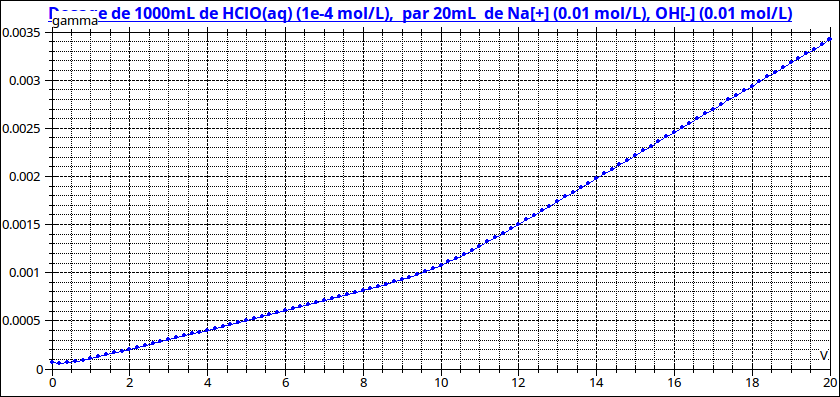
Excellente question ! Cet acide est très faible (pKa un peu supérieur à 7) ; c'est un polluant présent à très faible concentration dans certaines eaux (ici Ca=10-4mol/L).
Dans ces conditions, le saut de pH à l'équivalence est très faible ; la détermination du volume équivalent n'est pas précise. Un dosage conductimétrique donne de meilleurs résultats mais là encore, la rupture de pente à l'équivalence n'est pas très nette. Pour illustrer mon propos, voici les courbes pour le dosage de l'acide hypochloreux dont le pKa est très proche de celui-ci...Le volume équivalent vaut 10mL.