Inscription / Connexion Nouveau Sujet
Combustion méthanol
Bonjour
Voici un problème :
On réalise la combustion d?un corps pur, le méthanol.
1. Calculez la masse des fumées neutres pour 1 kg de méthanol brûlé.
2. Calculez le % de CO? massique dans les fumées neutres.
3. On analyse les gaz de combustion et on constate qu?il y a du dioxygène dedans, donc on a de l?air en excès. Le pourcentage massique de dioxygène est de 5%. Calculez la masse d?air en excès. Attention, n?appliquez pas de formule de manière automatique. Réfléchissez pour résoudre, en écrivant ce qu?est le pourcentage massique de O?, par exemple.
4. Calculez les pertes occasionnées par cet excès d?air, sachant que les fumées sont évacuées à 160°C.
Composant CO? H?Ovapeur N? SO? O?
Cp (KJ/kg/K) 0,815 1,9 1,03 0,9 0,916
1. J'ai trouvé : 7,75 kg/kg
2. 17,7 %
3. 1,7 kg
4. Il nous manque une température, je pense.
La professeur nous a juste donné ses réponses, j'ai trouvé comme elle pour les 2 premières questions et elle trouve 8,857 kg/kg pour la 3 et 371,7 kJ/kg pour la 4.
Je vous donne mon tableau des réponses en pièce jointe.
Merci pour votre aide.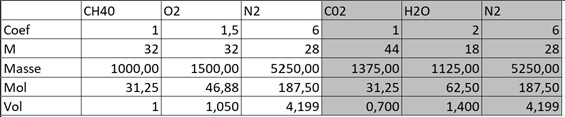
-----
***Titre corrigé***
J'ai fait 5% de la masse des fumée neutre : 387g de 02 donc n02 = 12, 11 mol.
nN2 = 4 x nO2 = 48,73 mol donc mN2 = 1356 g
Donc une masse d'air de 1743 g
Vous avez fait comment ?
La masse du gaz (les fumées neutres ?!?) a changé puisqu'on a ajouté de l'O2 et encore plus puisque pour 1 O2 ajouté on ajoute 4 N2. Il faut, comme le texte vous y invite, expliciter ce 5% = masse(O2)/(masse totale), la masse totale étant la masse initiale plus celle de O2 plus celle de N2 associée.
La masse au numérateur est la masse de 02 en excés ?
Et quoi corespondent les masse de 02 et N2 qui s'ajoutent aux fumées neutre (nom donné par le professeur à la somme des gaz des réactifs avec le N2) ?
Vous avez un mélange méthanol air avec de l'air en excès.
Appelons me la masse d'éthanol et ma=mas+mae la masse d'air (s pour stoechiométrique qui va donc réagir et e pour excès).
Après réaction me et mas ont donné le gaz de la question 1 ( m1) et mae n'a pas réagi et est toujours là.
La masse de gaz est donc m1+mae et dans ce gaz il y a 5% de O2 qui font partie de mae et qui est bien l'oxygène en excès.
Bonjour,
Ou à partir de la réaction sans air en excès. :
31,25 CH4O + 46,88 O2 + 187,50 N2 ----> 1375 CO2 + 1125 H2O + 5250 N2
On ajoute de l'air en excès, soit n moles de O2 et 4n moles de N2 (avec n à déterminer)
On a alors la réaction :
31,25 CH4O + 46,88 O2 + 187,50 N2 + n O2 + 4n N2----> 1375 CO2 + 1125 H2O + 5250 N2 + n O2 + 4n O2
La masse totale des gaz produits (m1) se calcule à partir de (1375 CO2 + 1125 H2O + 5250 N2 + n O2 + 4n O2)
La masse m2 d'O2 en fin de réaction (dans les fumées) se calcule à partir de (n O2)
Et la masse d'air excédentaire (m3) se calcule par (n O2 + 4n O2)
On doit avoir m2/m1 = 0,05 ... qui permet de calculer n et ensuite m2
En fin de mon message précédent, lire :
...
On doit avoir m2/m1 = 0,05 ... qui permet de calculer n et ensuite m3
Bonjour
J'ai essayé mais jamais je trouve votre résultats...
je doit me mélanger entre les différentes masses..
Je précise ma méthode :
Calcul préliminaire rapport masse de l'air/masse de O2 :
Pourcentage d'oxygène=
Bonjour,
Je poursuis en corrigeant ma réponse précédente (où j'ai écrit des masses au lieu des quantités de matière)
31,25 CH4O + 46,88 O2 + 187,50 N2 ----> 31,25 CO2 + 62,5 H2O + 187,5 N2
On ajoute de l'air en excès, soit n moles de O2 et 4n moles de N2 (avec n à déterminer)
On a alors la réaction :
31,25 CH4O + 46,88 O2 + 187,50 N2 + n O2 + 4n N2----> 31,25 CO2 + 62,5 H2O + 187,5 N2 + n O2 + 4n N2
masse des gaz : m1 = 31,25 * 44 + 62,5 *18 + 187,5 *28 + n *32 + 4n *28
m1 = 7750 + 143 n
Masse de O2 dans les fumées : m2 = 32.n
On doit avoir m2/m1 = 0,05 ... qui permet de calculer n = 15,6225 mol
masse d'air complémentaire (m3) : c'est la masse de (n O2 + 4n N2 ) avec n = 15,6225 ... qui donne alors m3 = 2250 g (2,25 kg)


