Inscription / Connexion Nouveau Sujet
cinétique de réaction
Bonjour à tous,
Je bloque sur le problème suivant :
on me donne la réaction suivante :
Avec les données suivantes :
ligne 1 : [S2O32-] (mM) ligne 2 : t(s)
La concentration de C3H7Br initiale est 39.5 mmol. trouver l'ordre de la réaction et calculer k.
J'ai pu faire un tableau d'avancement pour C3H7Br comme je connais la quantité de thiosulfate qui réagit à chaque fois mais je ne vois pas comment trouver k via le calcul parce que à aucun moment dans mon tableau d'avancement les concentrations en thiosulfate et C3H7Br ne s'égalise
Si quelqu'un pouvait me donner des piste ...
Bonjour
Attention aux charges des ions dans ton équation. Je pense que la réaction correspond à :
Les concentrations initiales étant du même ordre de grandeur : 95,6mmol/L pour les ions thiosulfate, 39,5mmol/L pour le bromure de propyle, je ne crois pas qu'il soit possible de démontrer de façon rigoureuse les valeurs des deux ordres partiels avec cette seule expérience. L'énoncé est-il complet ?
En revanche : il est possible de vérifier que les deux ordres partiels sont égaux à 1 :
En utilisant le tableau d'avancement, Il faut exprimer en fonction de
, reporter dans l'expression précédente puis résoudre l'équation différentielle dans laquelle tu n'as plus qu'une inconnue :
.
Oui l'énoncé est complet d'ou je bloque aussi ..je sais que la réaction est d'ordre globale 2 avec des ordres partiel 1/1 pour chacun des deux réactifs mais je ne vois pas comment arriver à cette conclusion ?? ( j'ai juste fait l'hypothèse qu'on avait un reaction type A+B-->C avec un ordre globale 2 et partiel 1/1 et utilisé la loi de vitesse correspondante ) mais comme je l'ait dit c'est juste " par hasard" et donc comment le démontrer rigoureusement ...
Désolé j'avais oublié les charges ..
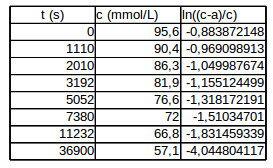
Je viens de faire le calcul... Es-tu bien sûr des deux dernières colonnes de ton tableau de valeurs ?
| réactifs | S2O32- | C3H7Br |
| concentrations initiales (mmol/L) | Co=95,6 | C'o=39.7 |
| concentrations à la date t(mmol/L) | Co-x | C'o-x |
| concentrations à la date t(mmol/L) | C | C-a |
puisque : C=Co-x, x = Co - C. La concentration en bromure de propyle est donc :
C'o-x=C-(Co-C'o) = C-a si on pose a = Co-C'o=55,9mmol/L.
C est ainsi solution de l'équation différentielle :
On sépare les variables :
Je te laisse démontrer :
D'où :
Je te laisse intégrer...
A propos du tableau de mesures : l'avant dernière valeur de t n'est certainement pas 1232s mais une valeur comprise entre 7380s et 78840s ; peut-être 12320s ? La dernière mesure conduit à un point aberrant sur la courbe qu'il faut tracer une fois trouvée la solution de l'équation différentielle.
Autre question : disposes-tu d'un tableur (Excel, LibreOffice...) ou d'une calculatrice graphique capable de tracer les courbes de tendances ?
Voici un tableau reconstitué et modifier pour les deux dernière dates de façon à être cohérent avec des ordres partiels tous deux égaux à 1.
La dernière colonne te fournit quasiment la solution...