Inscription / Connexion Nouveau Sujet
Chimie en solution aqueuse
Bonsoir,
Voila j'ai 2 questions de chimie que je ne comprend pas.
La première :
** exercice effacé ** 
![]() Chimie en solution aqueuse
Chimie en solution aqueuse
La deuxième : (concernant l'eau en tant que solvant)
Comment calculer en C.m et en D la norme  OH du moment dipolaire de la liason OH?
OH du moment dipolaire de la liason OH?
Je sais que  =
=  q
q  d
d
Mais que vaut  q ici ??
q ici ??
J'ai  h2o ,
h2o ,  (HOH) , doh et la valeur de 1D en C.m
(HOH) , doh et la valeur de 1D en C.m
Merci beaucoup
*** message dupliqué ***
Edit Coll : topic dupliqué, merci de respecter la FAQ, un problème = un topic 
![]()
Deuxième question.
Pour l'eau tu considères . La somme étant une somme vectorielle.
Tu as la molécule coudée plane suivante avec les moments dipolaires comme suit:
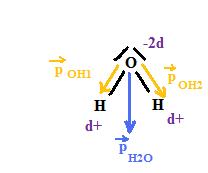
Le  q c'est simplement la différence de charge, et pour ça je te conseille de regarder le dessin
q c'est simplement la différence de charge, et pour ça je te conseille de regarder le dessin
*** message déplacé ***
Bonsoir, merci beaucoup de ta réponse.
Donc si j'ai bien compris:
 = -1
= -1  102.10-12 C.m
102.10-12 C.m
-1 représentant ici la différence de charge (charge partielle) pour OH.
non ce n'est pas possible d'avoir un moment dipolaire de molécule ou liaison de 10^-12 CM ... c'est beaucoup plus petit que cela .
Je n'ai pas compris l'enoncé exact de l'exercice que tu dois faire
- Shadwmiko t'explique d'ou provient le moment dipolaire d'une liaons OH. la laison OH est polarisée d- sur O et d+ sur H car le doublet de liaison est attiré par O et est statistiquement plus souvent vers O que vers H . Cette charge d ( en général notée delta ) est une fraction de la charge de l'électron e
- chaque liaison OH a un moment dipolaire , représenté par un vecteur et le moment dipolaire de la molécule d'eau est la somme vectorielle de ces deux vecteurs ( quand on fait la somme de deux vecteurs , l'angle entre les vecteurs joue un role ... c'est pourquoi on a du te donner l'angle HOH dans la molécule d'eau .
Salut  !
!
En gros tu dois bien faire µ=q*d=(1,6.10-19)*(valeur de ta charge). Théoriquement c'est 1,51 D
Sinon tu fais une addition vectorielle (ce dont on te parle avec anniejeanne) MH2O2 = 2*MOH2[1+cos(104)]
Tu comprends le principe?


