Inscription / Connexion Nouveau Sujet
Chimie - dosage
Bonjour,
On ajoute à 10mL d'une solution d'acide sulfureux H2SO3 de concentration CA = 0,2mol/L une solution de soude de concentration connue CB = 0,1 mol/L.
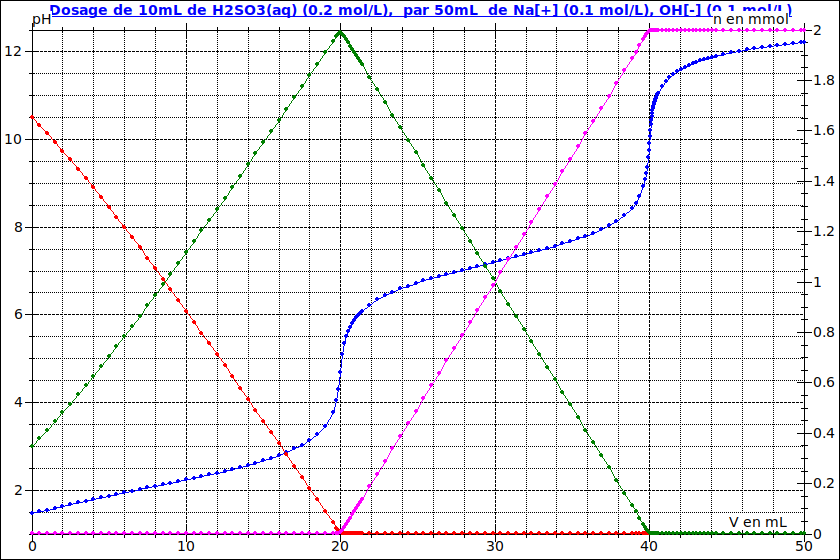
On s'intéresse à l'allure du pH en fonction du volume versé de soude. La courbe est tracée sur la figure ci-dessous. On va déterminer le pH pour V=0,0mL, 10,0mL, 20,0mL et 40,0mL. Pensez à vérifier les valeurs de pH que vous allez calculer par rapport à la courbe.
Détermination du pH initial : V1=0,0mL : Avant l'ajout de soude la réaction susceptible de se faire entre l'acide sulfurique et l'eau est :
H2SO3+H2O=HSO3- + H3O+ K=10^-1,8
1/ Compléter le tableau d'avancement
2/ Appliquer la L.A.M et déterminer l'avancement de la réaction à l'état d'équilibre
3/ Complétez alors le tableau ci-dessous. Vérifiez votre résultat sur la courbe ci-dessus.
J'ai ainsi donc le tableau d'avancement suivant avec Vtot=10mL :
H2S03 + H2O = HSO3- + H3O+
0,002 SOLVANT 0 0
0,002-xf SOLVANT xf xf
Ensuite j'applique la L.A.M où je pars de
J'ai ainsi xf = 0,00198 mol et mes concentrations à l'équilibre.
Mon problème, c'est qu'une fois que j'ai mes concentrations à l'équilibre, j'obtiens mon pH avec -log([H3O+]) et j'obtiens un pH égal à 3,70 qui n'est pas celui sur la courbe pour Vsoude=0mL.
Je pense m'être trompé dans le calcul de la L.A.M, ou peut être dans le calcul final des concentrations.
Avez vous une idée de mon erreur ?
Je vous remercie d'avance.
Bonjour
Pour la première question, dans la mesure où il est possible de négliger à la fois l'influence de la seconde acidité et l'influence de l'autoprotolyse de l'eau, la réaction que tu as écrite est bien la réaction prépondérante. Comme il n'y a pas encore d'ajout de soude, tu peux directement raisonner sur l'avancement volumique. En notant h la concentration en ions oxonium, tu obtiens :
[HSO3-]=h =[H3O+]; [H2SO3]=c-h
Tu obtiens directement l'équation vérifiée par h :
puis le pH.
Pour t'aider pour la suite, j'ai superposé à la courbe pH=f(V) les courbes représentant les variations des quantités (en mmol) en fonction de V :
courbe rouge : quantité de H2SO3
courbe verte : quantité de HSO3-
courbe rose : quantité de SO32- .