Inscription / Connexion Nouveau Sujet
Chimie dosage
Bonjour,
Voici le problème:
On veut déterminer la composition molaire d'un mélange d'acide chlorydrique HCl (H3O+ + Cl-) de conçentration c1 et d'acide phosphorique H3PO4, de conçentration c2. on ajoute donc une solution de soude (Na+ + HO-), de conçentration c3, le volume de soude ajouté est noté V.
pka de l'acide phosphorique : pka1=2.2 pka2=7.2 pka3=12.4
Ecrire les équations des réactions de dosages et calculer leurs constantes d'équilibres, ces réactions sont-elles successives ou simultanées ?
Ma réponse:
Les équations:
H3PO4+HO-=H2PO4-+H20
H2PO4-+HO-=HPO4(2-)+H20
HPO4(2-)+HO-=PO4(3-)+H20
Mais comment justifier que leurs réactions sont simultanées?
Bonsoir
Courage : tu es face à un des problèmes de pHmétrie contenant le plus de pièges...
1° Parmi les réactions de titrages, tu oublies la première concernant l'acide chlorhydrique :
H3O++HO- = 2H2 O ; K1=1014
ensuite, interviennent les 3 réactions que tu as écrites :
le dosage de H3PO4 de constante K2=1011,8
le dosage de H2PO4- de constante K3=106,8
le dosage de HPO42- de constante K4=101,6
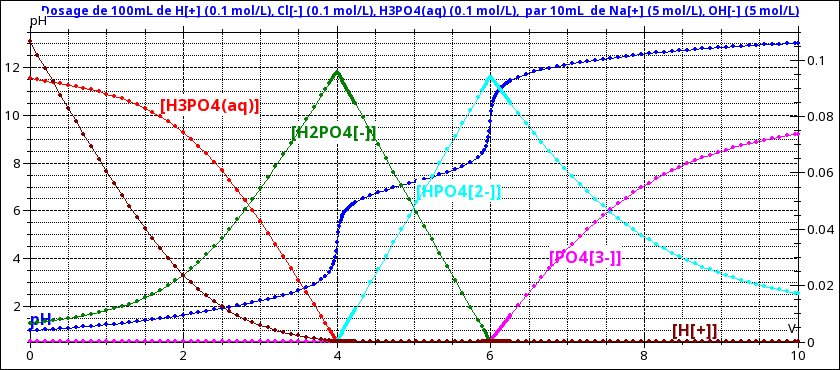
Pour t'aider à t'y retrouver, je joins une simulation où les concentrations ont été choisies de sorte que chaque réaction consomme 2mL de soude. On pourrait donc s'attendre à obtenir 4 sauts de pH pour des volumes de soude de 2, 4, 6, 8mL. On en observe en fait seulement 2...
Pour observer un saut de pH et donc pouvoir mesurer un volume équivalent, il faut deux conditions :
1° les réactions de dosage doivent être quasi totales donc avoir des constantes d'équilibre très grandes devant 1 (on fixe souvent un peu arbitrairement la condition à K>104). La quatrième réaction n'est que partielle : pas de saut de pH à v=8mL
2° les réactions doivent être successives et indépendantes. Cela suppose un rapport entre les constantes d'équilibre de deux réactions successives très grand devant 1 (là aussi supérieur à 104) sinon les réactions sont simultanées.
Résulte de tout cela les faits que :
- les réactions 1 et 2 sont quasi totales et simultanées. L'acide chlorhydrique et H3PO4 sont dosés simultanément ; pas de saut de pH à V=2mL ; un saut de pH à V=4mL correspondant à la quasi disparition simultanée de H3O+ et H3PO4.
- la réaction 3 est quasi totale et indépendante des précédentes et de la suivante. On observe un second saut de pH à V=6mL correspondant à la disparition de H2PO4-
- comme déjà dit, pas de saut de pH à V=8mL car la réaction 4 n'est que partielle.
Tu peux vérifier tout cela calmement par l'observation des différentes courbes de concentrations tracées dans le même repère.
Tout cela n'est pas simple. Pose des questions complémentaires si tu le juges utile.
Bonjour,
Effectivement votre réponse très detaillé ma beaucoup aidé, je m'excuse de ne pas y avoir répondu, en effet je l'ai lu et j'y ai réfléchi puis j'ai rédigé mon devoir, il était tard et avec la fatigue de la prépa j'ai complètement oublié de répondre ce qui est la moindre des choses, je m'excuse encore et un grand merci, car je n'aurai pas réussi sans vous !


