Inscription / Connexion Nouveau Sujet
Calculs de thermicités réactionneles isochores et isobares
Bonjour,
J'ai entrepris aujourd'hui de faire une exercice de thermochimie, j'ai réussis les 1eres questions (enfin je trouve les bonnes réponses, les valeurs numériques que l'on doit trouver nous étant données) même si la rédaction n'est peut-être pas vraiment bonne mais arriver à la dernière question je bute.
Voici l'exercice, peut-être qu'il vous inspirera plus que moi:
A 25°C, la combustion totale de 1.18g d'acide succinique C4O4H6 réalisée à volume constant dans une bombe calorimétrique dégage 14.895kJ, l'eau formée se trouve à l'état liquide.
Question 1: Calucler la thermicité réactionnelle isochore de la réaction de combustion de l'acide succinique à 25°C.
On a la réaction suivante C4O4H6(s) + (7/2)O2(g) --> 3H2O(l) + 4CO2(g)
On est à volume constant donc  U = QV =
U = QV =  rU *
rU *  max
max
Ce qui donne  rU = -1489.5 kJ.mol-1
rU = -1489.5 kJ.mol-1
Question 2 : En déduire la thermicité réactionnelle isobare
Je suis parti de H = U+PV ce qui me donne  rH =
rH =  rU +
rU +  rngaz *RT
rngaz *RT
On obtient alors  rH = -1488.261 kJ.mol-1 (1)
rH = -1488.261 kJ.mol-1 (1)
Question 3 : Calculer la thermicité réactionnelle isobare de cette même réaction à 25°C lorsque l'eau formée est à l'état vapeur.
Pour cette question on nous donne  rUvap = 41.534 kJ.mol-1
rUvap = 41.534 kJ.mol-1
En fait pour cette question j'ai fait ceci 3H2O(l) + 4CO2(g) --> 3H2O(g) + 4CO2(g)
Donc pour passer directement de l'acide succinique à l'eau gazeuse par combustion, on a
 rU =
rU =  rU (1) + 3
rU (1) + 3 rUvap = -1489.5 + 124.6 = -1364.9 kJ.mol-1 (2)
rUvap = -1489.5 + 124.6 = -1364.9 kJ.mol-1 (2)
On en déduit alors  rH =
rH =  rU (2) +
rU (2) +  rngaz *RT
rngaz *RT
=  rU (2) + (7- 7/2) *RT
rU (2) + (7- 7/2) *RT
= -1356.232 kJ.mol-1
Voilà, jusque là ça doit être bon. En fait c'est à la question suivante que je bloque. On nous dit que la combustion de 1.18g d'acide succinique est réalisée à la température initiale de 25°C dans une bombe calorimétrique de 224cm3, avec une quantité de dioxygène égale à 4 fois la quantité stoechiométrique. Et l'on doit calculer la température et la pression théorique maximale atteinte en supposant que la combustion est adiabatique et que l'eau formée est entièrement sous forme de vapeur. Pour cela on nous donne les capacité calorifique CV moyenne à volume constant entre 298 et 3000K pour CO2 O2 et H2O.
Et là je ne vois pas vraiment quoi faire....
Bonsoir,
je dirais que
1) pour le calcul de la température finale, il faut écrire :
où les "i" représentent tous les constituants à l'état final (produits de la réaction plus le dioxygène excédentaire)
2) Pour la variation de pression, utilisation de la loi des GP
on obtient ainsi :
où cette fois "i" veut dire état initial et "f" état final
Perso, je ferais ça mais je ne garantis rien 
A+
Oui donc avec ta formule 1) on peut trouver  T et donc Tmax (Tfinal).
T et donc Tmax (Tfinal).
Ca donne ca  U = QV =
U = QV = 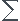 nfinalCV
nfinalCV T (je pense que c'est
T (je pense que c'est  U et non
U et non  rU.
rU.
Le problème est que d'après ce que j'ai cru comprendre, on doit trouver  T=2485K et donc Tmax=2783K
T=2485K et donc Tmax=2783K
Mais quand je fais mon application numérique je trouve des résultats complètement abberrants....
On a pourtant bien le droit de factoriser par  T??? Après ca me donne
T??? Après ca me donne  T = QV /
T = QV / 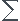
Avec nf,O[sub]2[/sub]=(21/2).10-2
nf,CO[sub]2[/sub]=4.10-2
nf,H[sub]2O[/sub]=3.10[sup]-2[sup]
En effet, c'est ...
est factorisable si les Cv ne dépendent pas de T sur l'intervalle consiéré.
Quel est ton résultat aberrant ? Peut tu fournir les valeurs des Cv ?
Cv(CO2) = 38.91 J.K-1.mol-1
Cv(O2) = 26.36 J.K-1.mol-1
Cv(H2O) = 38.91 J.K-1.mol-1
En fait j'avais dû faire une erreur, la je trouve  T = -2485K
T = -2485K
Donc il me reste encore un probleme de signe...


