Inscription / Connexion Nouveau Sujet
Calcule de pH
On dispose d'une solution à 0.2 mol.l^-1 (solution X ) et d'une solution d'acide chlorhydrique de même concentration ( Solution Y ) . le pKa du couple NH4+ /NH3 est 9.25.
1. Calculer le pH de la solution X , ainsi que la concentration des espèces présentes . justifier les calcules .
2 . Calculer les pH des solutions obtenues en mélangeant :
• 20 cm^3 de X et 10 cm^3 de Y
• 20 cm^3 de X et 20 cm^3 de Y
• 20 cm^3 de X et 30 cm^3 de Y
j'ai déjà fait la question 1 et j'ai obtenu pH = 11.27
mais pour la deuxième je suis bloqué je sais comment je peux calculer les pH ?
Bonsoir
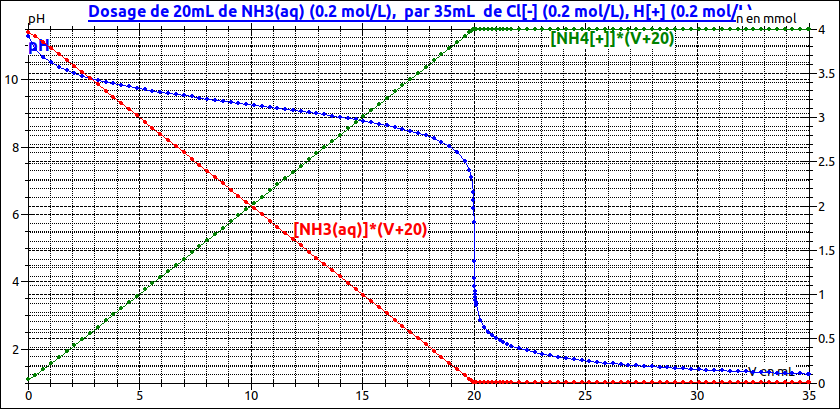
Tu as sans doute étudié le dosage d'une base faible par un acide fort. On étudie ici la demie équivalence, l'équivalence puis, une fois et demi le volume équivalent...
Pour t'aider un peu et te permettre de t'auto-corriger, voici une simulation informatique. La courbe représentant les variations de pH est en bleu. Pour t'aider à mieux comprendre, j'ai représenter dans le même repère (échelle de l'axe de droite) les variations en fonction du volume V d'acide chlorhydrique ajouté de la quantité d'ammoniac (courbe rouge) et de la quantité d'ions ammonium (courbe verte).