Inscription / Connexion Nouveau Sujet
Calcul de pH
Bonjour,
mon prof de physique-chimie m'a donné un DM sur le
calcul de pH cette semaine.
Je bloque totalement sur le premier problème.
Sur celui-ci, on doit calculer le pH de differents acides/bases et je bloque sur une espèce notamment, voici les informations:
Calculer le pH des solutions suivantes (faites pour les 4 autres): hydrogenosulfure de sodium (na+HS-)
-Cinitiale=10-2
-pka1(H2S,HS-)=7
pka2(HS-,S2-)=13
Sauf que je bloque deja sur l'éspece qui va réagir avec l'autre espece ? Va-t-il se former du S2- ou du H2S ?
Merci de votre réponse
Bonsoir
HS- est un ampholyte c'est à dire une espèce qui peut se comporter soit en acide soit en base.
Tu peux ainsi envisager 3 réactions possibles :
Celle de HS- sur l'eau, HS- se comportant en acide.
Celle de HS- sur l'eau, HS- se comportant en base.
Celle de HS- sur lui-même, la moitié des ions se comportant en acide, l'autre moitié se comportant en base.
Calcule les 3 constantes d'équilibre pour voir si par hasard une de ces réactions ne serait pas prédominante.
Donc après les calculs de constances d'équilibre,
avec K=10-|∆pka| et K=x2/(C0-2x)2, on obtiens :
-K1=10-7 (pour pka1)
-K2=10-13 (pour pka1)
Et K= x2/(C0-2x)2
Ce qui nous donne : x=C0*10-2
Soit x<<C0
Avec du coup x=10-4
On prend donc le cas de HS- qui réagit avec HS-
C'est bien ça ?
Ok pour K1 mais pas pour K2. Tu pourrais écrire l'équation de la réaction 2 et celle de la réaction 3 ?
Facile alors d'obtenir les deux constantes manquantes
si je résume, on a :
HS- + H2O = OH- + H2S avec K1=10-7
HS- + H2O = S2- + H3O+ avec Ka2 = x2/(c0-x)
d'ou on trouve x = ka2C0 - Ka2x - x2
donc on trouve x = 3.16 * 10-8
et
2HS- = H2S + S2- avec K3 = x2/(C0-x)2
d'ou  K =
K =  x2/(C0-x)2
x2/(C0-x)2
Tu confonds constante d'équilibre, valeur numérique à calculer en fonction de Ka1 et Ka2 avec le quotient de réaction à l'équilibre, c'est à dire les relations entre constantes d'équilibre et expressions des concentrations à l'équilibre. Ok pour K1 mais K2 et K3 ?
On est d'accord que le quotient de réaction a l'équilibre Qe, c'est :
Qe=K0(T)=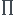 ai
ai i
i
Et donc la constante d'équilibre,
Ke=[H3O+][HO-]/[H2O]2 en général
Et Ka=[H3O+][A-]/[HA]
Et Kb=[HO-][HA]/[A-]
si je comprends bien ?
Mais dans le cas ici de l'ampholyte, on obtiens bien, après tableau d'avancement,
K3=x2/(C0-2x)2
Et pour K2, c'est comme K1 aussi non ?
C'est a dire 10-|∆pka|
D'où K2=10-|(pka2-pka1)|
Donc K2=10-5
Donc [K2]>[K1]
Revois la définition de la constante l'acidité Ka. Tu devrais aboutir à K2=10-13.
Pour K3 : multiplie numérateur et dénominateur de l'expression de K3 par la concentration en ions oxonium. Tu vas ainsi démontrer que K3 est le rapport des deux Ka.
Ah oui, j'avais le bon résultat mais j'ai fait une faute de frappe sur mon texte plus haut... (Pka1 a la place de pka2)
Donc K3 vaut :
K3=[H2S][S2-][H3O+]/[HS-]2[H3O+]
=Ka2/Ka1
=10-5
Donc K3>K1>K2
Donc c'est la réaction 3 qui a lieu
On peut donc appliquer
pH=1/2(pka1+pka2)
pH=10
Mais que se passe t il alors dans le cas où K3<K1 ou K2 ?
Bonsoir
La situation est un peu plus compliquée car 13-7=6 et pas 5...
Tu as donc K3=10-6 : valeur seulement 10 fois supérieure à K1. L'écart est trop faible pour pouvoir considérer la réaction 3 comme prépondérante. Tu peux négliger l'influence de la réaction 2 mais il faut tenir compte à la fois de 1 et de 3. Tu peux remplir un tableau d'avancement en notant "a" l'avancement volumique de 1 et "b" l'avancement volumique de 3. Les expressions de K1 et K3 conduisent à un système de 2 équations à 2 inconnues. K1 et K3 sont suffisamment petites devant 1 pour supposer les réactions très peu avancées :
Co-a-2b Co.
Co.
Bonjour,
Oupsiiii, encore voulu aller trop vite...
Après calcul et résolution du système, on trouve effectivement
a=10-10 et b=10-6
donc en effet a et b sont minoritaire devant C0
Mais je ne vois pas quelle formule utilisé... Je pensais a pH=1/2(pKe+Pka1-pC0) mais après lectures du résultat, j'ai un petit doute dessus.
Si c'est le cas alors pH=11.5 mais cela se rapproche beaucoup de pKa2
Tu obtiens "a" 10000 fois plus petit que "b" . Cela signifierait qu'il soit possible de négliger la réaction 1... Personnellement, j'obtiens avec Co=0,01mol/L :
a =10b
Peux-tu indiquer tes diverses concentrations en fonction de Co, a et b ?
Pour le pH : il faut réfléchir plutôt que de chercher à utiliser une formule toute faite qui ne correspond pas à la situation. Ton tableau d'avancement donne directement la concentration en ions hydroxyde en fonction de "a". Une fois calculée "a", on obtient le pH.
le système que j'ai pose est le suivant:
 (K3)*(C0-b)=b
(K3)*(C0-b)=b
K1(C0-a)=a
d'où après résolution:
b=1*10-6
a=1*10-10
mais je pense que je n'ai pas pris le bon système.
si on repart avec a=10b
on aurait dans K1:
K1= (10b)2/(C0-10b)
Ce qui nous donne :
K1C0-10K1b-10b2
b= 4*10-8
sinon je vois pas du tout la suite...
Pour voir d'où provient ton problème, indiques tes expressions en fonction de "a" et "b" des concentrations en :
HO-
H2S
S2-
Sachant que
[HS -] Co
Co
[HO-]=a
[H2S]=a ou [H2S]=[S2-]=b
Ce qui fait que :
K1= [HO-][H2S]/[HS-]=a2/(C0-a)
K3=[H2S][S2-]/[HS-]2=b2/(C0-2b)2
donc
K1=a(a+b)/C0
K3=b(a+b)/C02
Donc avec a = 10b d'où b=a/10
K1C0-11a2/10=0
K3C02-11b2=0
a=3*10-5
b=3*10-6
C'est bien ca ?
Cependant, on a un débat avec une autre élève de ma classe car ∆pka>4 donc les réactions sont censé être successive non ?
Oui. Pour terminer, ne pas oublier de vérifier la pertinence des approximations effectuées.
1° : [HS-]  : valide dans la mesure où le pH est compris entre pKa1+1 et pKa2-1.
: valide dans la mesure où le pH est compris entre pKa1+1 et pKa2-1.
2° : influence de l'autoprotolyse négligée : valide dans la mesure où le pH est supérieur à 7,5. (pH <6,5 pour une solution acide ).
Ok, cool, merci beaucoup !!!
Cependant, j'ai une question, ici ∆pka>4 donc les réactions ne sont pas censé être justement successive et pas simultané ?
Cette histoire d'écart de pKa supérieur à 4 intervient alors d'un dosage d'un polyacide ou d'une polybase ou d'un mélange d'acides ou de bases . Les dosages peuvent être considérés comme successifs et indépendants si l'écart de pKa est supérieur à 4. Les réactions successives doivent avoir des constantes d'équilibre très supérieures à 1...
Pas grand chose à voir avec cet exercice.
Donc dans tous les cas où on prend HA- au départ, les réactions sont successives et donc on refait le même calcul (par exemple avec la glycine, diacide où on nous demande de calculer le pH plus loin) ?
Parler de réactions successives fait intervenir obligatoirement le temps. Cela a du sens lors d'un dosage au cours duquel on ajoute progressivement la solution titrante. Ici tu as plusieurs équilibres qui existent en même temps. Pour que les calculs puissent éventuellement être simplifiés on commence par réfléchir à des simplifications possibles.


