Inscription / Connexion Nouveau Sujet
Caacité thermique
Bonsoir je bloque sur une question au milieu d'un exercice qui est la suivante pourriez vous m'aidez svp ?
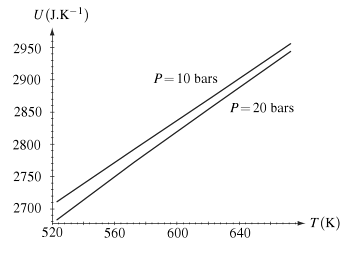
on dispose de valeurs expérimentales de l'énergie interne massique de la vapeur d'eau suivantes
| T(K) | 523 | 573 | 623 | 673 |
| à P=10 bars | 2711 | 2793 | 2874 | 2956 |
| à P=20 bars | 2683 | 2773 | 2859 | 2944 |
Comparer la capacité thermique à volume constant à celle d'un gaz parfait monoatomique
Alors j'ai pensé pouvoir établir la capacité thermique (nous venons de débuter le chapitre) en prenant de valeurs successives de U que l'on diviserait par deux valeurs successives de température mais ici rien ne me semble concluant et je ne vois vraiment pas comment exploiter ces valeurs. Merci d'avance
Salut,
On te donne une énergie interne en fonction de la pression et de la température.
Tu sais exprimer l'énergie interne pour une transformation isobare ou isotherme ?

Non je ne crois pas malheureusement je sais que dans le cas d'une transformation isochore dU=CvdT mais c'est tout à priori :/
La variation d'énergie interne est proportionnelle à celle de la température du fait qu'on a une droite.
Les deux courbes n'étant pas confondues, on en conclut que l'énergie dépend de la pression => le gaz n'est pas parfait : il faut tenir compte des interactions entre les molécules.
La calcul des pentes donnent respectivement :
28 J/mol pour P = 10 bars
29 J/mol pour P = 20 bars
ce sont les valeurs des capacités thermiques.
Dans le cas d'un gaz parfait monoatomique on aurait 3/2.R (cf le lien que je t'ai passé) = 12,5 J/mol.
Sauf erreur

Par contre en recalculant j'obtient :
1.6 J/mol pour 10 bars
1.8 J/mol pour 20 bars
Ces résultats me semble aberrants par rapport aux votre :/
Effectivement, tu as raison sur un point :
le graphique exprime U en J/K, alors qu'un énergie interne est en joules J
et la capacité thermique est en J/K !
Je pense que c'est une erreur d'inattention 
et n'oublie pas une chose :
il y a la capacité thermique en J/K
la capacité thermique massique en J/kg/K
la capacité thermique molaire en J/mol/K
Donc attention aux unités aussi 
Merci mais du coup piur retrouver leur valeur on fait
Cv= delta(U) / delta(T) ? Où les deltas sont les différences de deux valeurs successives ? Car je ne retrouve pas leur résultat ^^
L'énoncé te dit :
"énergie interne massique" --> J/kg si c'est en unité SI
"température" --> K
donc tu auras une capacité thermique massique en J/kg/K
Ensuite, pour un gaz parfait monoatomique, tu sais que
Je ne comprend plus rien ^^ D'accord pour les unités mais on a dit que les gaz considéré n'était pas parfait et je ne comprend plus du tout qu'est ce que je doit trouver exactement car je vais obtenir un résultat en J/kg/K comme vous l'avez dit, que je doit comparer avec la valeur de 12,5 J/mol les unités ne correspondent alors pas du tout
Regarde uniquement ce que j'ai écrit à 15h52 et 53, je t'ai tout mis dans les bonnes unités  .
.
Tu calcules les pentes et tu compares à la valeur de la capacité d'un gaz parfait.
J/mol ne peut pas être l'unité d'une capacité thermique donc je suis d'accord, la correction du livre est mauvaise.

 .
.