Inscription / Connexion Nouveau Sujet
Atomistique
Bonjour,
J'ai fait un exercice d'atomistique et j'avoue que j'ai peur d'être à coté de la plaque parce que je n'utilise pas tous l'énoncé pour répondre.
J'espère que vous pourrez m'aider et merci d'avance.
Le Magnésium Z=12 existe sous forme de 3 isotopes de nombre de masse 24, 25 et 26. Les fractions molaires dans le magnésium naturel sont respectivement 0,101 pour 25Mg et 0,113 pour 26Mg.
Déterminer la valeur approchée de la masse molaire atomique du magnésium naturel.
Alors déjà la consigne en elle même me pose problème parce que je ne vois pas trop ce que vient faire une fraction molaire la dedans. Donc voilà ce que j'ai fait:
m(atome)= m(noyau) + Zme-
Et m(noyau)=Zmp+(A-Z)mn = 12*1,00727+524-12)*1,00866=24,19116 uma
m(atome)= 24,19116+ 12*5,5.10^-4= 24,19776 uma
Merci d'avance.
Bonjour
Tu te compliques la vie. En très bonne approximation, la masse d'une mole d'atomes XAX est égale à À grammes.
Bonjour,
En approximation,
si est la faction molaire de chaque isotope
son nombre de masse.
la masse molaire approchée de l'espèce chimique considérée.

Bonjour gbm
Pas bien grave !  Je serais curieux de savoir si le "clic" sur "vérifier la présence de nouvelles réponses" est opérationnel pour un laps de temps aussi bref.
Je serais curieux de savoir si le "clic" sur "vérifier la présence de nouvelles réponses" est opérationnel pour un laps de temps aussi bref.
@ EmojiGrin : mon correcteur automatique a ajouté un accent sur le "A" ; lire dans mon message : masse d'une mole d'atomes = A grammes
Merci beaucoup pour vos réponses ! hyper rapides en plus 
Donc si j'ai bien compris on a:
Mi=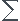 xi*Ai (d'ou la question suivante de l'exercice qui demandais pourquoi on avait un résultat approximatif)
xi*Ai (d'ou la question suivante de l'exercice qui demandais pourquoi on avait un résultat approximatif)
M= x25*25+ x26*26 + x24* 24
et x25+ x26+x24=1
x24=1-0,101-0,113=0,786
M= 0,101*25+0,113*26+0,786*24=24,327
En fait je n'avais pas pensé à remplacer Mi par Ai
Mais du coup je me demandais si c'était quand même possible de trouver le résultat avec ce que j'avais fait au début?
La méthode que tu as utilisée au début est un peu compliquée mais peut conduire à un résultat approché si tu remarques que à 1uma correspond une masse molaire de 1g/mol. Tu vas cependant obtenir un résultat un peu plus élevé que la réalité car ton calcul ne prends pas en compte le défaut de masse correspondant à l'énergie de liaison des nucléons à l'intérieur du noyau. Je te fournis les masses molaires atomiques des trois isotopes du magnésium. Tu vas constater que l'approximation recommandée par gbm et moi-même est tout à fait justifiée.
isotope 24 : 23,98504g/mol
isotope 25 : 24,98584g/mol
isotope 26 : 25,98259g/mol
Je serais curieux de savoir si le "clic" sur "vérifier la présence de nouvelles réponses" est opérationnel pour un laps de temps aussi bref
Il est en principe réparé depuis plusieurs semaines, j'ai tout simplement omis de l'employer.



