Inscription / Connexion Nouveau Sujet
variance et relations particulières
Bonjour,
J'ai une question à propos des calculs de variance :
Dans mon cours on avait écrit la réaction suivante : Hg2O(s)=2Hg(g)+1/2 O2(g)
On a calculé la variance qui vaut v=n+2-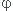 -r avec :
-r avec :
n : nombre de constituants physico-chimiques
2 : P et T
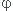 : nombre de phases
: nombre de phases
r : nombre d'équilibre
On a donc v=3+2-2-1=2
et à T fixée et comme on a la relation particulière xHg=4xO2, la variance réduite vaut alors : v'=0
Or dans un autre exercice on avait : NiCO3(s)=NiO(s)+CO2(g)
avec v=3+2-1-3=1 (calculé comme ci-dessous)
Mais pourquoi dans ce cas on n'a pas la variance réduite v'=0 vu qu'on a xNiO(s)=xCO2(g) ?
Merci d'avance !
Bonjour
Attention au piège!
Chaque constituant est ici seul dans sa phase. Les activités des solides existants sont égales à un et la fraction molaire du gaz vaut toujours un.
Bonsoir,
Je ne suis pas sûre d'avoir bien saisi :
- pourquoi la fraction molaire d'un gaz vaut toujours 1 ? (je dirais que c'est parce-que les gaz sont "libres" dans l'atmosphère mais j'aimerais bien avoir une explication stp)
- est-ce que tu sous-entends qu'on ne peut comparer les fractions molaires que de constituants dans la même phase ?
- l'activité d'un solide étant égale à 1, est-ce que sa fraction molaire est toujours égale à 1 ?


