Inscription / Connexion Nouveau Sujet
Variance
 etudiantilois
etudiantiloisBonjour,
Un corps pur en équilibre sous deux phases (a) et (b), à la température T, est soumis à une pression Peq qui dépend de T et de la nature du corps pur.
Montrer que, si l'on fixe la température, alors la pression est fixée pour l'équilibre entre les deux phases.
Je pense faire un calcul de variance en utilisant la formule de Gibbs pour les systèmes physiques :
v=N+2-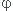 -P.
-P.
Avec N : nombre de constituants physicochimiques.
2 : P et T a priori facteurs d'équilibre.
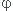 : nombre de phases.
: nombre de phases.
P : particularités.
Dans le cas décrit ci-dessus on aurait donc : N=1 (corps pur)
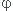 =2 car il y a 2 phases.
=2 car il y a 2 phases.
P=0 car il n'y a pas de condition de travail particulière.
On obtiendrait donc : v=1+2-2-0=1.
Que pensez-vous de ce raisonnement ? Est-il correct ?
Merci beaucoup pour l'aide.
Bonsoir
Dans le cas d'un corps pur présent sous 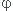 phases, la variance est donnée par la relation :
phases, la variance est donnée par la relation :
v=3-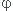
Ah oui merci !
Mais ce que j'ai fait est correct ou pas ? Ou c'est faux ? Parce que dans le corrigé ils mettent que N le nombre d'espèces physicochimiques présentes est égal à 2...
Bonsoir
Dans le cas d'un corps pur présent sous
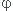 phases, la variance est donnée par la relation :
phases, la variance est donnée par la relation :
v=3-
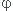
En fait là j'ai un problème : il est écrit dans un livre : v=2-
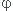 pour un corps pur !!
pour un corps pur !!La formule de Gibbs conduit effectivement à la relation que je viens de préciser. Il faut cependant ce méfier de cette formule car il est facile de "piéger" les étudiants qui l'utilisent sans réfléchir un jour de concours ou d'examen.
Il est souvent aussi rapide et moins piégeant de repartir de la définition de la variance et d'écrire celle-ci comme la différence :
v=X - Y avec :
X= nombre de paramètres intensifs du problème
Y = nombre de relations entre ces paramètres à l'équilibre.
J'ai répertorié dans le document ci-dessous, paragraphe II.9, pages 18 et suivantes, quelques exemples où la détermination de la variance à partir de la formule de Gibbs peut se révéler piégeante.
![]()
Ton document précise : "variance dans le cadre de l'étude". J'imagine qu'il est précisé par ailleurs que la pression est systématiquement maintenue fixe dans cette étude, ce qui impose une condition particulière.
Réfléchis au cas particulier du point triple : 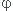 =3
=3
v=0 (pas -1 !) : cela signifie que l'équilibre sous trois phases n'est possible qu'à une température donnée et à une pression donnée. Par exemple pour l'eau :
T3=273,16K ; P3=611,3Pa
Oui vous avez raison il est précisé juste au dessus que la pression est maintenue constante.
Encore une question :
pourquoi dans le corrigé ils mettent que N le nombre d'espèces physicochimiques présentes est égal à 2 ?! Alors qu'on est en présence d'un corps pur ?
Sachant que leur formule de la variance est différente de la mienne, eux ils écrivent :
v=N-K-r+2-phi
Avec :
N le nombre d'espèces physicochimiques présentes. 2
K le nombre d'équilibres physicochimiques. 1
r le nombre de paramètres fixés par les conditions expérimentales. 0
2 : paramètres intensifs P et T.
phi le nombre de phases. 2
J'ai mis en bleu leurs valeurs...
Je me permets une démonstration "propre" (du moins j'espère  )
)
Système : un corps pur en équilibre sous 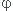 phases :
phases :
Les paramètres intensifs du problème : P et T donc X=2
Les relations entre ces paramètres intensifs : le potentiel chimique est le même entre les différentes phases en équilibre : cela introduit (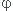 -1) relations.
-1) relations.
Refléchis : si 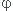 =1 : aucune relation d'équilibre
=1 : aucune relation d'équilibre
si 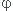 =2 : une relation :
=2 : une relation :  (phase1)=
(phase1)= (phase2)
(phase2)
si 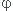 =3 : deux relations :
=3 : deux relations :
 (phase1)=
(phase1)= (phase2) et
(phase2) et  (phase3)=
(phase3)= (phase2)
(phase2)
Donc :
v=2-(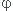 -1)=3-
-1)=3-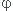
La dernière phrase de ton dernier message n'a pas de sens a priori mais il faudrait connaître le contexte précis...
Posts croisés... Tu pourrais peut-être changer de livre d'exercices... Tu pourrais m'indiquer ses références ?
Il existe d'excellents livres pour la filière BCPST.
Merci pour la démonstration !
Donc il y a une erreur dans le corrigé du livre ?!
Voici exactement ce qu'il y a écrit. Est-ce correct ?
** image supprimée **
Tout à fait d'accord avec le dernier paragraphe de ton document. En revanche, si la démonstration du premier paragraphe concerne l'équilibre d'un corps pur sous 2 phases, elle est inadaptée . Je t'ai fourni une démonstration détaillée générale pour l'équilibre d'un corps pur sous 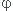 phases.
phases.
Pardon je me suis trompé de pièce-jointe ! Vraiment désolé. Je parle de ce corrigé. Est-il correct ?
** image supprimée **
Tout dépend de ce qu'on appelle une espèce physico chimique. Tu devrais oublier cette démonstration et, soit revenir à la règle de Gibbs classique rappelée dans mon document, soit utiliser la démonstration que je viens de faire.
OK, alors je vais suivre votre conseil et oublier cette démonstration !
Une autre question de thermodynamique : pourquoi lors d'un changement d'état on a :  rG=0 ?
rG=0 ?
Est-ce bien vrai ?
Ton livre semble traiter le problème comme une réaction chimique d'équation bilan :
H2O l = H2Ov
J'ai pris l'exemple de l'eau mais il peut s'agir de tout autre corps pur.
Pour un tel équilibre l'affinité chimique A est nulle et de façon générale :
A= - rG
rG
Donc à l'équilibre :  rG=0. (Voir document que je t'ai indiqué)
rG=0. (Voir document que je t'ai indiqué)
Dans le cas d'un corps pur sous 2 phases, il est plus direct d'écrire l'égalité des potentiels chimiques mais la méthode de ton livre est correcte et conduit au même résultat.
C'est la condition générale d'équilibre chimique. La démonstration, peut-être pas à ton programme, est sur le document que je t'ai indiqué.
Merci beaucoup, je vais regarder.
J'ai posté une autre question de thermodynamique dans un autre sujet,...


