Inscription / Connexion Nouveau Sujet
Valeur de la constante a l'équilibre
Bonjour à tous, j'aurais besoin pour déterminer Xeq. Sur l'image j'ai indiqué la constante d'équilibre, ainsi que mon tableau d'avancement. Pour déterminer Xeq, connaissant K° qui vaut 0.663, je comptais approximer certains valeurs, pour isoler xeq. Par exemple que (2-xeq) = 2. Et ainsi retrouver la valeur attendu qui est de : xeq = -0.46. Or j'y arrive pas. J'aurais donc voulu savoir si il fallait appliquer une autre méthode.
Merci d'avance.
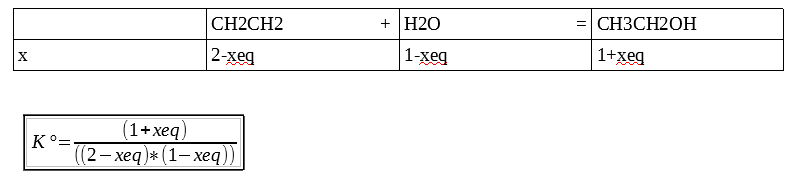
Bonsoir
Si tu développes le dénominateur, tu vas constater que l'expression de K° à l'équilibre est en fait une équation du second degré dont il faut retenir la seule solution physiquement admissible : celle comprise entre 0 et 1. Aucune simplification évidente n'est possible dans la mesure où K° n'est ni très grand ni très petit devant 1.
Salut,
Tu peux développer l'expression de ton Ko et trouver une équation du 2nd degrès en xeq à résoudre.
Je rencontre un problème, j'ai calculé mon équation du second degré, or je trouve deux racines 0.11 et 4.39. J'en déduis que 4.39 n'est pas possible car supérieur a xmax. Or 0.11 n'est toujours pas le bon résultat. Dans mon exercice, on me dit que les quantités de matières des constituants a l'équilibre sont : nCH2CH2 = 2.46, nH2O = 1.46 et nCH2CH3OH = 0.54.
Je n'arrive pas à retrouver la valeur attendue.
Si tu avais fourni d'entrée l'énoncé complet... La réponse est encore beaucoup plus simple, trop simple à mon avis pour un exercice enseignement supérieur...
xeq vérifie, selon ton tableau d'avancement, les trois égalités suivantes :
2,46=2-xeq
1,46=1-xeq
0,54=1+xeq
Dur ! Dur !
K° ne sert à rien ici !
Tu peux peut-être, histoire de faire quelque chose, vérifier que l'expression de K° que tu as indiquée correspond bien à la valeur numérique de K° fournie par l'énoncé !
J'ai juste fais une erreur dans mon message, 2,46 1,46 et 0,54 sont les résultats que je suis censé trouver après avoir déterminer xeq, il ne sont pas donnés dans l'exercice, mais dans les réponses que je suis censé trouver. C'est sur que sinon j'aurais pas posé la question.
Je comprends mieux ainsi !
Je comprends aussi que tu ne t'en sortes pas . Si on prend la valeur de xeq fournie par ton énoncé et ton expression de K° à l'équilibre, on obtient K°=0,150, pas 0,663 ! Si on retient la valeur K°=0,663, j'obtiens comme toi xeq=0,112mol.
Attention cependant : on peut imaginer (sans énoncé complet...) que l'équilibre est obtenue à température élevée en phase gazeuse. Dans ces conditions, la constante thermodynamique d'équilibre s'exprime, dans le cas particulier des conditions d'équilibre, en fonctions des pressions partielles des trois gaz assimilés à des gaz parfaits. La pression partielle étant le produit de la pression totale P par la fraction molaire. La quantité totale de gaz étant (4-xeq), cela donne :
(P° = pression standard de 1bar)
En posant P=P°, on obtient xeq= -0,464mol soit la réponse attendue !
D'où l'intérêt d'un énoncé complet pour une aide efficace !


