Inscription / Connexion Nouveau Sujet
Utilisation du chlore dans le traitement des eaux
Bonjour je suis bloqué sur la question 2 de cet exercice dont voici l'énoncé:
L'électrochloration est une application de l'électrolyse qui permet de produire sur place
les produits nécessaires à la désinfection et à la production d'eau potable.
On évite ainsi le stockage sur site et le transport de produits dangereux.
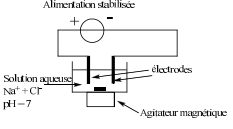
On se propose d'étudier le principe de ce procédé au laboratoire. (schéma en fin de page). On considère que les électrodes sont inertes chimiquement.
1) Après avoir fait le bilan des espèces présentes en solution, écrire toutes les demié-quations rédox susceptibles de se produire à l'anode et à la cathode.
2) A l'aide des données (potentiels standard et potentiels apparents à pH = 7), écrire
l'équation de la réaction d'électrolyse qui devrait se produire thermodynamiquement.
3) En raison de problèmes cinétiques, on observe à l'anode la formation de dichlore, à la
cathode un dégagement de dihydrogène et la formation d'ions hydroxyde HO.
Ecrire l'équation bilan de la réaction d'électrolyse.
4) La cellule d'électrolyse n'est pas compartimentée et le milieu est constamment agité,
donc il se produit la dismutation du dichlore en milieu basique.
a) Ecrire l'équation de la réaction de dismutation.
b) Comment appelle-t-on, dans la pratique, la solution ainsi formée ?
5) On réalise l'électrolyse d'un volume V = 200 mL d'une solution saturée de chlorure de sodium en imposant un courant constant d‘intensité I = 0,500 A pendant 30 min.
a) Déterminer la quantité de matière théorique de dichlore n(Cl2)TH formée à l'anode.
b) Après 30 minutes d'électrolyse, on dose les ions hypochlorite formés par iodométrie.
On détermine une concentration en ions hypochlorite égale à 1,70.10-2 mol.L-1.
En déduire la quantité de matière de dichlore formée n(Cl2)F lors de cette électrolyse.
c) Calculer le rendement faradique η de l'électrolyse.
J'ai écris qu'à l'anode il peut y avoir les réactions d'oxydations suivantes:
2Cl- + 2e-= Cl
O2 + 4H+ +4e- = 2H20
Et à la cathode les réactions de réductions:
2H+ + 2e- = H2
Na+ + e- = Na
Pour la questions 2 j'ai l'impression qu'aucune réaction ne se fait spontanément en raison du fait que les espèces à l'anode ont toutes un potentiel standard plus élevées que celles des espèces à la cathode. Mais cela me semble improbable...
Voici le schéma du montage et les données de l'exercice: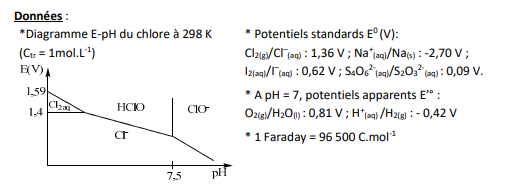
Bon déja j'ai fait une erreur les oxydations possibles c'est:
2Cl- = Cl2+ 2e- et O2+4H+=2H20+4e-
Et puis peut-être que comme c'est une électrolyse la règle du gamme est inversé et donc la réaction sans blocage cinétique qui se produit est:
8H+ + O2= 2H2O+ 2H2?
Bonjour
OK pour la réaction à l'anode. Pour la cathode, c'est la décomposition de l'eau avec fortion de dihydrogène et d'ions hydroxyde.