Inscription / Connexion Nouveau Sujet
tpe rx
bonjour, je suis à la recherche du coefficient d'atténuation linéaire 03
si quelqu'un le connais merci de répondre au plus vite. Merci beaucoup de sauver les tpe de 3 élèves en difficultés.
Le coefficient d'atténuation dépend évidemment de l'énergie des photons X, de la nature du gaz (Ici O3), mais évidemment aussi de la pression ... qui joue très fortement sur la probabilité qu'un photon X a de 'rencontrer" une molécule de O3 sur une épaisseur donnée de gaz.
Pas de soucis pour répondre à ce genre de question pour des solides, mais pour les gaz ...
Sur ce site, ![]() , lire page 31 et suivantes (chapitre 3.4.2)
, lire page 31 et suivantes (chapitre 3.4.2)
Tu n'auras pas la réponse sous la forme que tu espères ... mais tu comprendras peut-être pourquoi.

merci pour ta reponse mais je n'es pas compris le document et du coup est-il possible de calculer ce coef ou non?
Ici : ![]()
On trouve ces courbes :
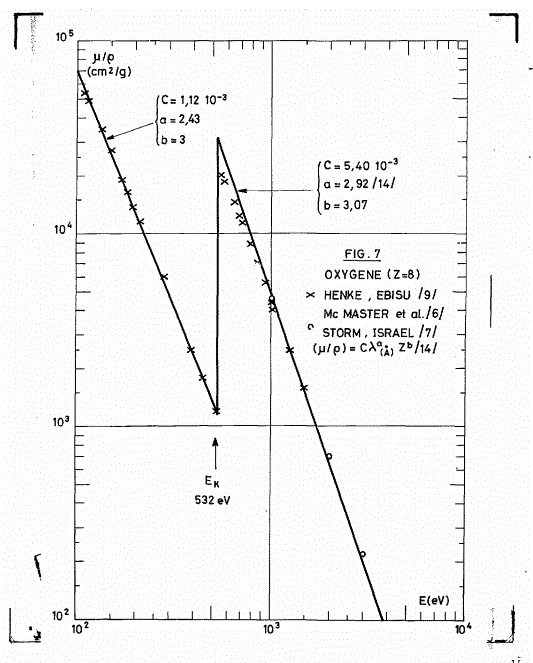
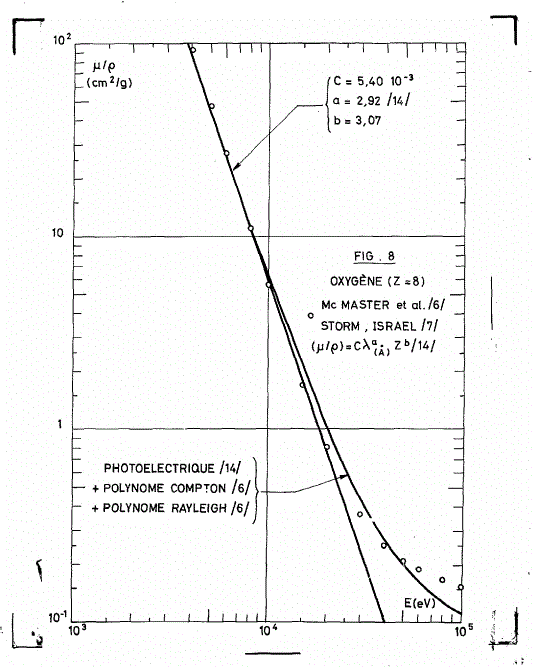
Ce sont les graphes du coefficient d'atténuation MASSIQUE pour l'oxygène en fonction de l'énergie des photons.
Pour l'O3, on peut multiplier les coefficients de l'O par 3.
On remarquera que les coefficients sur les graphes sont les coefficients MASSIQUES, soit les avec
la masse volumique du gaz.
On voit que comme je l'ai dit et répété, le coefficient d'atténuation dépend de l'énergie des photons et que comme je n'ai cessé non plus de le répéter, si on veut calculer le , il faut connaître la masse volumique du gaz à l'endroit où on désire faire des calculs d'atténuation.
Si ta question reste " je n'es pas compris le document et du coup est-il possible de calculer ce coef ou non? " ... je ne peux plus rien pour toi.
Et si ton prof sort une formule de son chapeau avec une valeur numérique pour sans indication sur l'énergie des photons concernés et sans la masse volumique du gaz, alors ...

M(3) = 48 g/mol
PV = RT (pour 1 mol)
V = RT/P
Rho = M/V
Rho = P*M/(RT)
Et donc Rho dépend de la pression et de la température.
Dans les conditions dites normales de température et de pression (P = 101300 Pa et T = 273 K), on a donc : Rho = 101300 * 48.10^-3/(8,31 * 273) = 2,14 kg/m³
OUI, MAIS ...
Cela c'est à P = 101300 Pa et T = 273 K, soit à pression atmosphérique normale au niveau de la surface de la Terre (de ma mer) ... et à 0°C.
Par contre, si on veut être dans les conditions de température et de pression là où on trouve la couche d'ozone dans l'atmosphère, les conditions de température et de pression sont très différentes.
Si j'en crois ce dessin (piqué sur le net) :
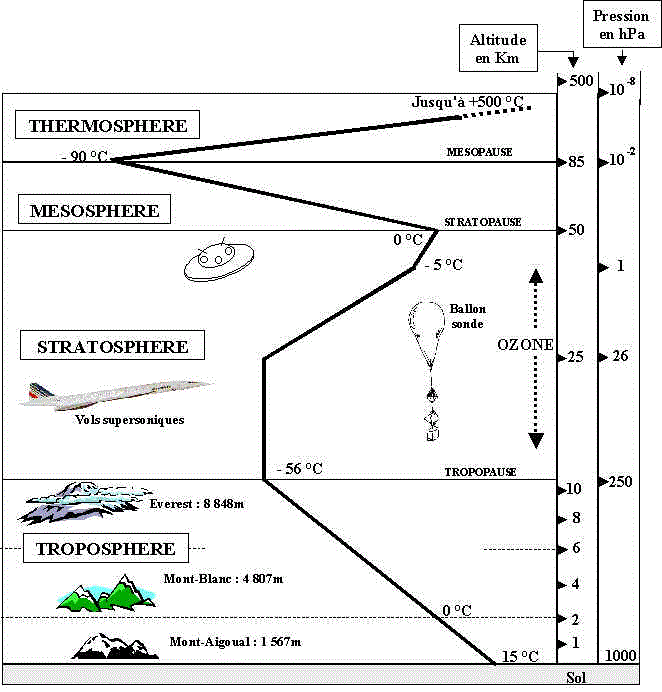
la couche d'ozone aurait la pression variant avec l'altitude de 200 à 1 hPa et la température variant comme indiqué (de - 56°C à 0°C)
Et donc une masse volumique variable en fonction de l'altitude et bien moindre que celle calculée au niveau de la mer.
-----
Je continue à ne pas cerner la portée réelle de ce que tu espères trouver.
Le problème est bien plus complexe que tu ne sembles le penser et probablement aussi à celui qui t'a demandé le travail .
On ne peut pas répondre un peu sérieusement aux questions telles que tu les poses, sans en connaître les buts et surtout les conditions (température, pression, énergies des photons incidents ...)



