Inscription / Connexion Nouveau Sujet
Tp organomagnésien acide benzoïque
Bonjour,
Dans un tp que j'ai préparé et qui consiste à préparer un organomagnésien puis l'utiliser pour faire de l'acide benzoïque, on me demande dans la partie concernant l'hydrolyse et le traitement du benzoate à quoi sert de rajouter de l'acide chlorydrique. Je pense que c'est pour pouvoir faire l'extraction liquide-liquide par la suite car HCl va aller avec la phase aqueuse mais je ne suis pas sûre. Est-ce que c'est bien cela ?
Merci de votre aide 
Bonjour,
Trop peu d'informations sur le protocole utilisé pour avoir un avis sur cette question.
Juste une hypothèse ( d'où l'emploi du conditionnel )
L'acide chlorhydrique ( avec 2 " h " dans le mot ) réagirait avec un benzoate présent pour obtenir la précipitation de l'acide benzoïque.
Voici le protocole:
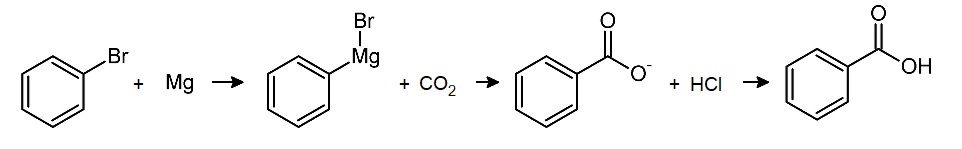
Dans un erlenmeyer prélever 70 mL d'éther anhydre sous la hotte. Ajouter à l'éther anhydre 10 mL de bromobenzène sous la hotte. Placer ce mélange dans l'ampoule de coulée. Introduire 2,3 g de magnésium en copeaux dans le ballon et un barreau aimenté. Verser dans le ballon environ 10mL de la solution de bromobenzène placée dans l'ampoule de coulée. Ajouter ensuite goutte à goutte la solution de bromobenzène. Attendre 30 min. On observe le reflux de l'éther. Plaer des petits morceaux de glace carbonique (10g) dans un bécher sec de 500 mL et ajouter 10 mL d'éther anhydre. Verser le magnésien sur le CO2 liquide. Agiter jusqu'à ce que le CO2 disparaisse. Ajouter de la glace dans le bécher et verser 50mL d'HCl molaire. Agiter jusqu'à disparition de la glace. Introduire ce mélange dans une ampoule à décanter et recueillir la phase organique. Traiter deux fois la phase organique avec de la soude à 10%. Récupérer es phases aqueuses. Acidifier à l'HCl molaire jusqu'à obtenir pH<3. Essorer les cristaux sur Buchner. Sécher les cristaux sur papier filtren puis à l'étuve. Recristalliser une partie du produit brut obtenu dans l'eau. Essorer les cristaux sur Buchner, puis les sécher. Peser le produit obtenu et calculer le rendement.
J'ai aussi une nouvelle question : on me demande ensuite de calculer le rendement de la synthèse avant et après purification.
Je ne sais pas si je dois faire une équation bilan à partir de l'organomagnésien formé ou avec les produits utilisés pour former l'organomagnésien.
Je dirai que l'équation bilan est : Mg + bromobenzène + CO2--> acide benzoïque + eau + bromure de phényle magnésium
Je sais que mon équation bilan est fausse mais je n'arrive pas à l'écrire 
Je sais que c'est quelque chose de base qu'il faut savoir faire mais j'ai toujours du mal à les écrire quand on nous donne un protocole car je ne sais jamais qu'elles sont les espèces qu'on doit y mettre ou pas.
Merci de votre aide 
Voilà qui confirme mon hypothèse. On précipite l'acide benzoïque par protonation des ions benzoate. En effet l'étape suivante est la filtration puis le séchage du précipité obtenu.
On peut imaginer de calculer le rendement soit à partir des réactifs de départ (Bromobenzène et Magnésium) soit à partir de l'organomagnésien et du CO2.
En pratique tu n'as pas accès aux masses de l'organomagnésien ni à celle de CO2. J'en déduis que c'est donc le rendement global qui est demandé.
Ce rendement doit être calculé à partir de la quantité de matière du réactif limitant (soit le bromobenzène, soit le magnésium. Les réactions qui s'enchaînent ont lieu mole à mole donc le rendement sera le rapport entre la quantité de matière d'acide benzoïque obtenue et la quantité de matière de réactif limitant utilisée.
Merci 
Par contre pour l'équation bilan ce serait quoi du coup ? bromure de phényl + Mg + CO2 --> acide benzoïque ?
Bonjour Kiecane : Masse moléculaire de l'acide benzoïque C6H5COOH ( C7H6O2 = 122 )
Le Bromure de phénylmagnésium formé , va réagir avec le CO2 pour donner
du benzoate de magnésium . Par acidification avec HCl , on va l'hydrolyser en acide
benzoïque et le Mg va donner du chlorure de magnésium + l'excès de bromobenzène .
L'extraction par la solution de NaOH 10% , va faire passer l'acide benzoïque en benzoate de
sodium . La phase alcaline réacidifiée avec du HCl , va donner un précipité d'acide benzoïque .
Isoler les cristaux comme tu as fait etc ....
2,3g de Mg = 2,3 : 24,32 = 0,0946 mol . Comme tu n'indique pas la quantité de bromobenzène
il y donc a un excès que l'on va retrouver à la fin de la réaction .
Avec un rendement quantitatif ( 100% ) , tu devrais obtenir 0,0946 mol d'acide benzoïque
soit 0,0946 x 122 = 11,54g d'acide pur .
Pour calculer le rendement de la réaction , tu divise le nombre de grammes obtenu
par 11,54 puis multiplier par 100 .
Exemple avec 9g ====> ( 9 : 11,54 x100 ) = 78% .
Bonnes salutations .
Bonjour, je comprends comment calculer le rendement mais j'aurais bien aimé trouver aussi l'équation bilan s'il-vous-plaît et je ne sais pas comment l'obtenir
molecule 10, on nous indique qu'on met à 2 reprises 10 mL de bromobenzène lors de la réaction (cf début du grand texte  )
)
J'ai essayé de trouver l'équation bilan et le rendement théorique soit :
éther anhydre + bromobenzène + Mg + CO2 --> acide benzoïque
éther anydre : je ne sais pas comment calculer sa quantité de matière
bromobenzène : n=20*10^(-3) *1,49 = 2,98*10^(-2)
avec densité du bromobenzène = 1,49
Mg: n=2,3/24=9,58*10^(-2)
CO2: n=10/44=2,27*10^(-1)
Donc le bromobenzène est le réactif limitant et le rendement max est r= 2,98*10^(-2)
Merci d'avance à ceux qui corrigeront mes erreurs
Attention.
Dans un premier temps tu mélanges 10 mL de bromobenzène avec 70 mL d'éther.
En faisant cela tu prépares une solution de bromobenzène ( L'éther ne participe pas à la réaction c'est seulement un sovant )
Plus tard tu mélanges environ 10 mL de cette solution de bromobenzène avec 2,3g de Zinc.
Avec ces seuls renseignements tu ne peux pas connaître la quantité de matière de bromobenzène utilisée. C'est pourquoi molécule 10 en a déduit qu'il était en excès et que c'est donc le Zinc qui est le réactif limitant.
Tu réclames une équation de réaction.
Il suffit de relire ce que je t'ai déjà écrit et ce que molécule 10 t'a également indiqué.
Il ne s'agit pas ici d'UNE réaction mais d'un enchaînement de 3 réactions :
a) Réaction entre le bromobenzène et le zinc pour obtenir le bromure de phénylmagnésium (organomagnésien)
b) Réaction entre le bromure de phénylmagnésium (obtenu à l'étape précédente) et le dioxyde de carbone (en excès) pour obtenir du benzoate de magnésium.
c)Réaction entre le benzoate de magnésium (obtenu à l'étape précédente) et l'acide chlorhydrique pour obtenir de l'acide benzoïque (et du chlorure de magnésium)
Les opérations qui suivent sont des opérations d'extraction et de purification.
Les trois réactions sont déjà indiquées sous forme schématique dans mon post du 7/10/17 à 11h50
Comme te l'a déjà indiqué molecule 10 Le calcul du rendement se fait à partir des 2,3g de Magnésium soit à partir de 2,3/24,32 = 9,46.10-2 mol de magnésium
Les trois réactions se faisant mole à mole il en résulte que si le rendement était de 100% tu devrais retrouver en fin de synthèse 9,46.10-2 mol d'acide benzoïque soit 9,46.10-2*122 = 11,5 g de ce produit.
Il suffira donc de faire le quotient entre la masse effectivement obtenue et cette masse théorique de 11,5 g (et multiplier par 100 le résultat) pour obtenir le rendement
Plus tard tu mélanges environ 10 mL de cette solution de bromobenzène avec 2,3g de Zinc. .....
... C'est pourquoi molécule 10 en a déduit qu'il était en excès et que c'est donc le Zinc qui est le réactif limitant.
a) Réaction entre le bromobenzène et le zinc pour obtenir le bromure de phénylmagnésium ...
Désolé.
Au début et au milieu du texte, pour je ne sais quelle obscure raison j'ai utilisé le mot "Zinc" là ou je pensais "Magnésium". A corriger donc.
Bonsoir,
Je ne comprends pas pourquoi le bromobenzène ne pourrait pas être le réactif limitant puisqu'on nous donne sa densité : d=1,49 et qu'on en met 10 mL donc on peut calculer sa quantité de matière non ?
Relis ton protocole :
"Dans un erlenmeyer prélever 70 mL d'éther anhydre sous la hotte. Ajouter à l'éther anhydre 10 mL de bromobenzène sous la hotte"
Comme déjà expliqué le 16/10 à 23h06 en faisant cela tu prépares (70 + 10) = 80 mL d'une solution de bromobenzène
Et puis plus loin après avoir introduit le magnésium :
"Verser dans le ballon environ 10mL de la solution de bromobenzène placée dans l'ampoule de coulée."
Tu as donc introduit environ 10 mL non pas de bromobenzène, mais de solution de bromobenzène ce qui n'est pas la même chose.
Et le terme "environ" t'enlève tout espoir de calculer la masse exacte de bromobenzène réagissante.
Ok c'est plus clair merci 
Durant ce tp on a aussi fait une chromatographie sur couche mince avec de l'acide benzoïque commercial de l'acide benzoïque avant recristallisation et de l'acide benzoïque après recristallisation. On obtient les 3 taches sur la même ligne. Est-ce que c'est normal ?
Bonjour,
Oui, c'est normal.
L'acide benzoïque commercial sert de référence.
Les trois dépôts que tu as fait sur la CCM sont censés soit être de l'acide benzoïque pur soit un mélange d'acide benzoïque et d'impuretés.
Les trois taches ayant migré à la même hauteur correspondent à la même molécule (acide benzoïque).
Les autres (éventuelles) tâches correspondent à des impuretés.
Cette chromatographie te permet donc d'authentifier que tu as bien synthétisé de l'acide benzoïque par comparaison avec la référence et de juger du degré de pureté de l'acide benzoïque obtenu.
Autre chose au sujet de la quantité de bromobenzène utilisé:
A y relire de plus près il me semble finalement que la totalité des 10 mL de bromobenzène initialement mélangés avec 70 mL d'éther anhydre (soit 80 mL de solution) a été introduite en deux fois dans le mélange réactionnel.
A savoir : Environ 10 mL directement dans le ballon
Et ensuite le restant (70mL) au goutte à goutte par l'intermédiaire de l'ampoule de coulée.
Si les choses se sont bien passées ainsi, on peut calculer la quantité de matière de bromobenzène utilisée :
Comme la quantité de Magnésium introduite était de 9,46.10-2 mol
on peut en conclure que les deux réactifs ont été introduits dans les proportions stchiométriques et le rendement peut être calculé soit à partir du Magnésium, soit à partir du bromobenzène. On choisira celui des deux réactifs qui a été mesuré avec le plus de précision.



