Inscription / Connexion Nouveau Sujet
TP - Équilibres de précipitation - solubilité
Bonjour,
Je suis en pleine préparation d'un TP portant sur les équilibres de précipitation - solubilité et je bloque sur quelques questions (j'ai déjà pu répondre à la majorité d'entre elles).
1) Dans un premier temps, on étudie l'équilibre de solubilité de MnS :
MnS(s) = Mn2+(aq) + S2-(aq)
Sachant que l'ion S2- est la dibase conjuguée du diacide faible H2S, on nous demande de montrer que dans une solution de Na2S de concentration totale C, la concentration en ions S2- est :
avec K1 = K(H2S/HS-) = 10-7
et K2 = K(HS-/S2-) = 3,2. 10-13
J'ai essayé de faire un tableau d'avancement, mais j'ai l'impression que je m'emmêle les pinceaux... De quel côté faut-il partir et quelles équations faut-il poser pour débloquer la situation ?
2) Dans un second temps, on étudie le dosage par conductimétrie d'une solution de KCl par une solution de AgNO3 :
J'ai commencé à écrire les valeurs de conductivité avant, pendant et après l'équivalence (je ne suis pas certain des expressions) :
- avant : λCl-(CaVa-CbVb)/Vt + λK+CaVa/Vt + λNO3-CbVb/Vt
- pendant : λK+CaVa/Vt + λNO3-CbVb/Vt
- après : λAg+(CbVb-CaVa)/Vt + λK+CaVa/Vt + λNO3-CbVb/Vt
On me demande sous quelle condition on peut exprimer la conductivité de la solution titrée sous la forme A + B * VAGNO3 (avec A et B des constantes).
Pour cette question, je ne sais pas ce qu'on attend de nous... Qu'entend-t-on par "condition" ? Que faut-il faire pour trouver une expression de cette forme ?
Merci d'avance pour votre aide !
Bonjour
La question 1 demande d'obtenir l'expression générale de la concentration sans approximation. Il faut combiner la conservation de l'élément soufre et les expressions des Ka à l'équilibre. Pour alléger les notations, je pose : . Sachant que Na2S est totalement soluble dans l'eau et que la solution ne contient pas encore d'ions manganèses susceptibles de provoquer la précipitation, les ions sulfure, soit ne réagisse pas avec l'eau, soit il réagissent pour produire HS- soit il réagissent pour produire H2S :
Je te laisse exprimer les rapports de concentrations en fonction de h et de K1 et K2...
Merci beaucoup pour ces précieuses indications, j'aurais vraiment eu du mal à voir qu'il fallait partir de la conservation du l'élément.
K1 = [HS-] h / [H2S]
K2 = [S2-] h / [HS-]
Ce qui fonctionne très bien en remplaçant les expressions dans la formule.
Pour la partie 2 : je ne comprends pas tes notations "avant", "pendant" "après" mais tu as effectivement trois cas à étudier :
cbVb<CaVc
CbVb=CaVa
CbVb>CaVa
J'imagine que tu pose Vt=Va+Vb . Dans ces conditions, la courbe avant et la courbe après l'équivalence sont des branches d'hyperboles. Cependant, si Ca<<Cb, on aura toujours : Vb<<Va et donc Vt Va : les hyperboles sont assimilables à des portions de droites. D'où les fonctions affines dont parle ton énoncé.
Va : les hyperboles sont assimilables à des portions de droites. D'où les fonctions affines dont parle ton énoncé.
Je voulais dire "avant l'équivalence", "à l'équivalence" et "après l'équivalence". De même, j'ai omis de préciser que j'avais posé Vt = Va+Vb... Désolé.
Un grand merci pour votre aide, je pense avoir tout compris !
Bonne journée 
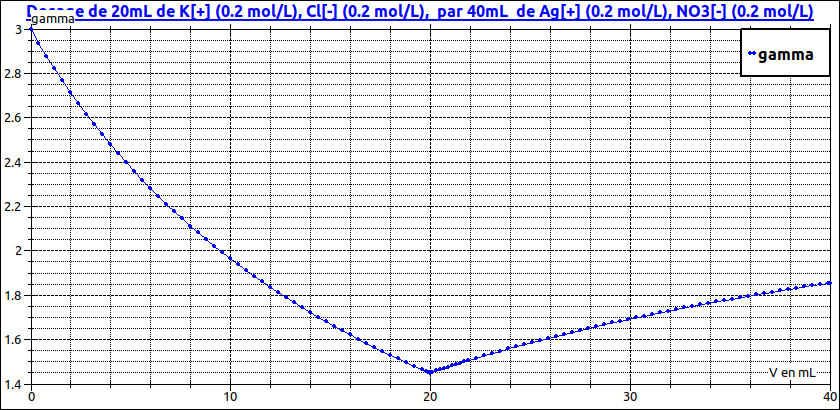
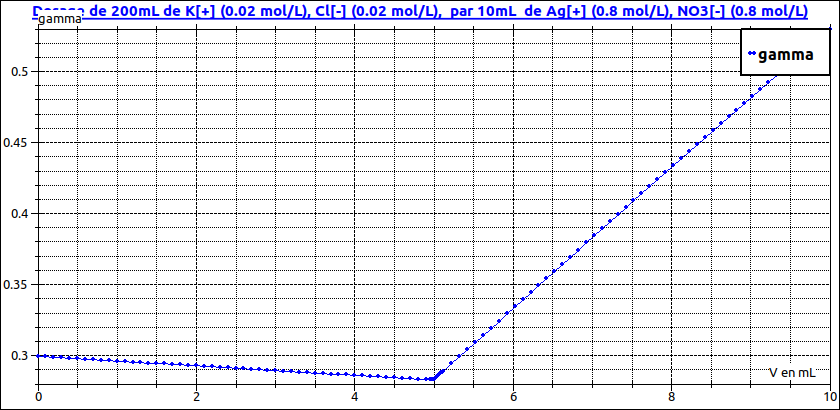
Pour illustrer mes remarques sur les courbes assimilables ou non à des droites.
Première courbe : cas un peu "extrême" : je choisis Ca nettement supérieur à Cb. Les courbes ne sont pas du tout assimilables à des droites. Difficile en pratique de repérer graphiquement le volume équivalent : en pratique, il y a beaucoup moins de points que dans cette simulation informatique.
Deuxième courbe : je choisis Ca nettement inférieure à Cb ; le volume total varie peu en passant de 200mL à 210mL : les courbes avant et après l'équivalence sont assimilables à des droites ; facile de tracer ces deux droites à la règle et de considérer que l'équivalence correspond à l'intersection des deux droites. Méthode précise malgré le peu de points expérimentaux que l'on possède en pratique (beaucoup moins que dans cette simulation).