Inscription / Connexion Nouveau Sujet
Titrage conductimétrique d'un acide faible par une base forte
Bonjour, j'ai besoin de votre aide. Voilà mon TP:
Je dilue une solution de 6ml d'acide acétique de concentration Ci avec 94mL d'eau distillée, et je la nomme F5. Je mesure la conductivité de F5 que je la dose progressivement avec de l'ammoniaque à 0,1N. Je dose en ajoutant des portions de 0,2 mL d'ammoniaque, je mesure la conductivité de F5 jusqu'à ce que la conductivité devienne constante.
Je prépare ensuite 10mL d'acide acétique de concentration Ci, que je dilue avec 90mL d'eau distillée, je nomme cette solution F4. Je mesure ensuite la conductivité de la solution F4.
Je prépare ensuite 16mL d'acide acétique de concentration Ci, que je dilue avec 84mL d'eau distillée, je nomme cette solution F3. Je mesure ensuite la conductivité de la solution F3.
Je prépare ensuite 20mL d'acide acétique de concentration Ci, que je dilue avec 80mL d'eau distillée, je nomme cette solution F2. Je mesure ensuite la conductivité de la solution F2.
Je prépare ensuite 25mL d'acide acétique de concentration Ci, que je dilue avec 75mL d'eau distillée, je nomme cette solution F1. Je mesure ensuite la conductivité de la solution F1.
Je dois calculer la concentration Ci, C1, C2, C3, C4 et C5 respectivement les concentrations: de la solution initiale, de la solution F1, de la solution F2, de la solution F3, de la solution F4, de la solution F5
Voilà, je n'arrive pas à calculer les concentration en utilisant les conductimétries.
Bonjour
je mesure la conductivité de F5 jusqu'à ce que la conductivité devienne constante.
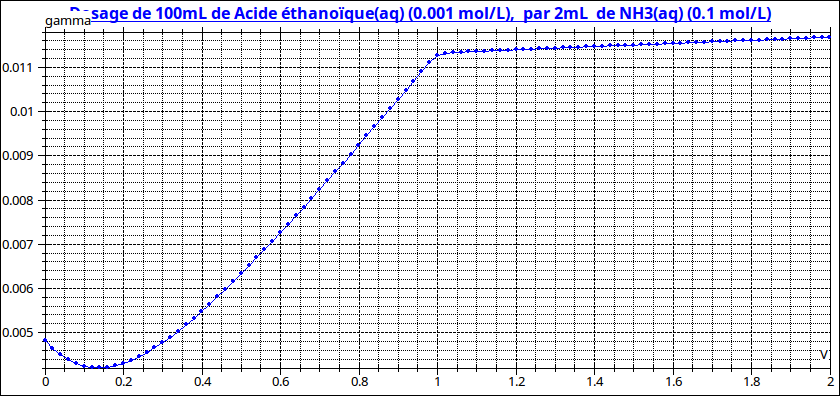
Une fois terminée la réaction de dosage entre l'ammoniac et l'acide éthanoïque, la conductivité ne reste pas rigoureusement constante : même si l'effet de dilution est négligeable, la réaction très partielle de l'ammoniac sur l'eau libère des ions ammonium NH4+ et des ions hydroxyde OH-, ce qui entraîne une faible augmentation de conductivité. Cependant, la rupture de pente à l'équivalence est très nette, ce qui permet de mesurer le volume équivalent et donc d'obtenir directement C5. (voir courbe ci-dessous : une équivalence correspondant à 1mL de solution d'ammoniac ajoutée correspond à C5=10-3mol/L)
La suite n'est qu'un simple problème de dilution...
Ayant C5, tu calcules Ci puis les autres concentrations compte tenues des dilutions... Les conductivités n'interviennent pas dans ces calculs...
Les conductivités mesurées peuvent servir à déterminer le taux de réaction sur l'eau de l'acide éthanoïque qui varie avec sa concentration mais il s'agit probablement de la suite du T.P. ...