Inscription / Connexion Nouveau Sujet
Titrage acido-basique d'un mélange H2SO3 et H2SO4
Bonsoir, voici l'énoncé :
Le titrage d'un volume V=10mL d'un mélange de H2SO3 (de concentration C1) et de H2SO4 (de concentration C2) par de la soude molaire fait apparaitre deux équivalences pour les volumes Veq1=1,5 mL et Veq2=2,0 mL de soude versée, marquées respectivement par le virage de l'hélianthine et de la phénolphtaléine.
Données :
| Indicateur | Zone de virage |
| hélianthine | 2,4-4,4 |
| phénolphtaléine | 8,2-9,9 |
H2So3: pKa1=2 et pKa2=7
H2SO4 : 1ère acidité forte, pKa=2
1. Ecrire les équations se déroulant à chaque équivalence en justifiant.
J'ai dit que H2SO4 est un acide de première acidité forte donc il réagit directement avec l'eau : H2SO4 + 2H2O = SO4-- + H3O+
Il y a donc trois équations:
(1) SO4-- + H3O+ HO-=SO4-- + 2H2O car H3O+ est l'acide le plus fort et HO- la base la plus forte
(2) H2SO3+HO- = HSO3- + H2O
(3) HSO3- + HO- = SO3-- + H2O
Je bloque pour attribuer les volumes équivalents : j'ai trouvé ça mais ça me parait un mal justifié (si c'est vrai):
-La réaction qui a lieu en premier est celle avec le pKa le plus élevé donc (3) a lieu en premier.
-(1) et (2) ayant un
2.Déterminer les concentrations en quantité de matière C1 et C2
Il me faut déjà savoir si j'ai juste à la question 1 mais il va très certainement falloir utiliser le fait qu'à équivalence, les réactifs sont introduits en proportion stchiométrique donc C1V=CsoudeVeq1
Et avec mon raisonnement de la question 1, il y a problème pour C2 :/
En revanche, je ne vois pas à quoi peut servir le tableau en donnée.
Merci bonne soirée
Bonsoir
Première équivalence : dosage des deux acidités de H2SO4 et de la première acidité de H2SO3.
Deuxième équivalence : dosage de la seconde acidité de H2SO3.
Tu as fourni la justification : il faut un écart de pKa de 4 ou plus pour obtenir des dosages successifs et indépendants.
Pour t'aider un peu et t'auto-corriger, voici une simulation informatique de ce dosage. En bleu, la courbe pH=f(Vb) montrant les deux sauts de pH correspondant aux deux équivalences successives.
Les autres courbes montrent les évolutions en fonction de Vb (volume de solution de soude ajouté) des diverses concentrations. Cela fait un peu "fouilli" mais les diverses hypothèses sur les réactions et leur caractère total ou non y sont bien illustrées.
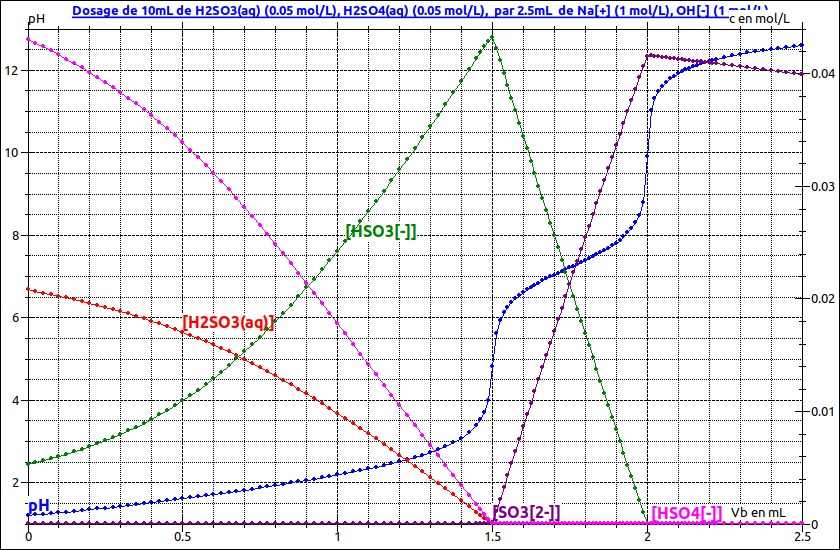
D'accord, merci beaucoup pour la simulation, c'est déjà plus clair.
Mais comment fait-on pour déterminer C1 et C2 puisque les réactions ont lieu simultanément ?
Ecrire que Vb1=1,5mL correspond au dosage des deux acidités de H2SO4 et de la première acidité de H2SO3 te fournit une première relation entre C1 et C2.
Ecrire que les 0,5mL de soude ajouté entre la première et la deuxième équivalence dose la deuxième acidité de H2SO3 permet d'obtenir C2, la concentration en H2SO2 de la solution initiale à étudier.
Bonjour,
je ne vois pas quoi écrire à part
C1V=CbVeq1
et
C2V=CbVeq1
ce qui reviendrait à dire que C1=C2 et ce qui semble faux d'après la simulation (surtout qu'on aurait même pas besoin de la deuxième équivalence)
Le titre de la simulation contient le résultat :
C1=C2=0,05mol/L
j'utilise les notations de l'énoncé :
Le titrage d'un volume V=10mL d'un mélange de H2SO3 (de concentration C1) et de H2SO4 (de concentration C2)
La mise en équation de mon message précédent conduit à :
(C1+2C2).V=Cb.Vb1
C1.V=Cb.(Vb2-Vb1)
Puisque tu as deux inconnues (C1 et C2), il te faut deux équations, d'où la nécessité de mesurer Vb1 et Vb2.
Ecrire que les 0,5mL de soude ajouté entre la première et la deuxième équivalence dose la deuxième acidité de H2SO3 permet d'obtenir C2, la concentration en H2SO2 de la solution initiale à étudier.
C1.V=Cb.(Vb2-Vb1)
Ne serait-ce pas plutôt C2 pour le coup ?
Dans un de mes premiers messages, j'avais inversé le sens de C1 et de C2. C'est pour cette raison, que j'ai tenu, dans mon message précédent à rappeler ce que désignent C1 et C2.
A la première équivalence, les deux acidités de H2SO4 sont dosés, d'où le "2C2" qui apparaît dans la première formule ainsi que la première acidité de H2SO3, d'où le "C1" qui apparaît dans la première formule..
Entre la première et la deuxième équivalence, on dose la deuxième acidité de H2SO3, d'où le "C1" qui apparaît dans la deuxième formule.


