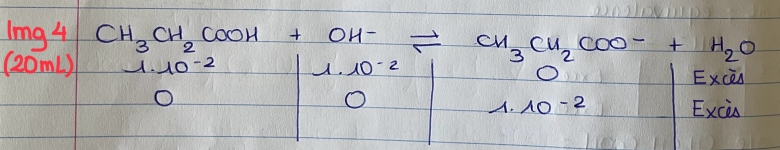Inscription / Connexion Nouveau Sujet
Titrage acid fort base forte
Bonjour,
50 ml d'acide chlorhydrique 0,2 mol.L^1 sont ajoutés à 50 mL d'acide propanoique de même
titre et de pKa= 4,8. Le mélange est titré par la soude NaOH de concentration 1,0 mol.L^1
Calculer le pH correspondant à l'addition de: 9 mL; 10 mL; 15 mL et 20 mL de soude
Pour faciliter les calculs, on ne tiendra pas compte du volume de soude ajouté.
Faut il commencer par calculer le pH de base puis celui apres l'ajout de NaOH ?
Bonjour
commence par faire un tableau d'avancement. Un exercice très analogue est traité sur la fiche que j'ai rédigée il y a quelque temps. Tu peux t'en inspirer et l'adapter. Cela mes semble un peu difficile compte tenu de tes connaissances actuelles. Relis attentivement mes messages précédents et ceux de gts2 et de grâce, le commence pas par écrire que la réaction entre l'acide chlorhydrique et la solution de soude est : HCl + NaOH  ...
...
![]()
Petite mise au point : si tu visites un laboratoire de chimie, tu verras peut-être des flacons étiquetés "HCl 0,2M" ou "NaOH, 1M" avec "M" abréviation parfois utilisée de "mol/L". Malheureusement, certains énoncés d'exercices reprennent ces étiquettes, ce qui peut induire en erreur les étudiants peu familiarisés avec ces notions.
Comme dit et redit, HCl est un gaz appelé chlorure d'hydrogène, stable à l'état pur mais qui se comporte en acide fort : il est donc totalement instable dans l'eau et réagit sur celle-ci de façon totale pour donner de façon totale de l'acide chlorhydrique :
HCl + H2O  H3O+ + Cl-
H3O+ + Cl-
L'étiquette "HCl 0,2M" ne signifie pas la présence de molécules HCl, on peut écrire dans l'acide chlorhydrique : [HCl]=0. Cela signifie seulement que l'acide chlorhydrique du flacon a été obtenu en introduisant Ca=0,2mol/L de HCl, ce qui conduit à :
[H3O+]=[Cl-]=Ca.
Les ions hydroxyde sont ultra minoritaire puisque Ca est grand devant 10-7mol/L.
De même NaOH à l'état pur est constitué de cristaux (solide) très solubles dans l'eau selon la réaction :
NaOH(solide)  Na+ + HO-
Na+ + HO-
L'étiquette "NaOH, 1M" signifie que la solution de soude a été obtenue en introduisant par litre de solution : Cb=1mol/L de cristaux de soude, ce qui conduit à une solution telle que :
[Na+] = [HO-]=Cb
les ions oxonium H3O+ sont ultra minoritaires dans la solution dans la mesure où Cb est grand devant 10-7mol/L.
Rem 1 : Tout cela n'est que répétitions de mes précédents messages et de ceux de gts2 mais parfois, répéter les fondamentaux peut s'avérer utile. 
Rem 2 : Il est parfois toléré de noter H+(aq) l'ion oxonium H3O+ mais je ne te le conseille pas pour l'instant. La notation H3O+ visualise mieux le transfert d'ion H+ entre acide et base.
J'ai lu un petit peu votre fiche et la dernière conversation, j'ai essayé de faire l'exo voila ce j'ai pour le moment :
La base reagira d'abord avec l'acide le plus fort qui est HCl
La reaction est : H+ + OH- —> H2O
On fait un tableau d'avancement img
Le reactif limitant est OH -
On regarde les moles finales de H+ : 1*10^-3
On fait c = n(H+)/Vsol = (1*10^-3)/0,1 = 0,01
pH = -log [H+] = 2
Est - ce correcte ? Si il y a une erreur ou est elle
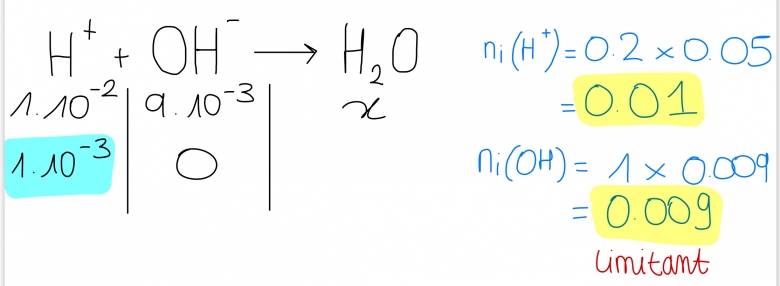
Reprend les généralités décrites dans mon document en laissant tomber le paragraphe 3 sur le dosage par conductimétrie. Tu vas pouvoir considérer le dosage du mélange comme une succession de deux dosages indépendants (voir paragraphes 1 et 2). Cela te conduit à définir deux volumes équivalents de soude que je note VE1 et VE2.
Il faut commencer par calculer ces deux volumes pour savoir quelle situation étudier.
Ton tableau d'avancement correspond seulement à une situation telle que Vb<VE1.
Pour t'aider un peu, voici la courbe représentant les variations de pH du mélange en fonction de Vb : le volume de solution de soude ajouté. Tu remarquera bien sûr les ressemblances avec la courbe du document fourni précédemment : les raisonnements à faire sont strictement identiques. Seule la valeur du pKa de l'acide faible est un peu différente. Tu pourras aussi vérifier tes calculs...
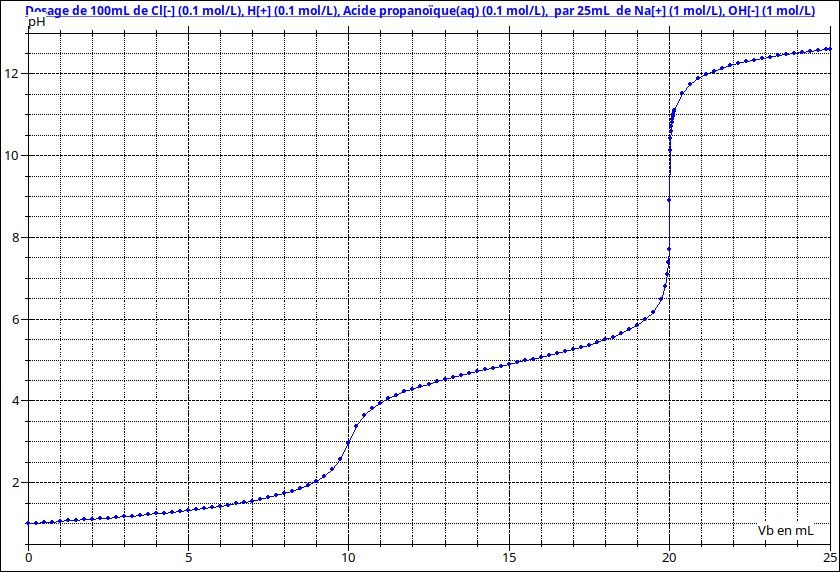
Bonjour,
Apres avoir fais beacoup d'exercices simples, je suis revenu sur cet exo qui m'avais posé probleme.
J'ai trouvé des valeurs proches avec celle du graphique mais parfois un peu differentes
Je vous montre ce que j'ai fais :
9 ml :
Tableau d'avancement img1
C(H+) = n/V = 10^-3 / 0.1 = 10^-2
PH = -log (H+) = -log (10^-2) = 2
10 ml :
Tableau d'avancement img2
10 ml est le V equivalent - toutes les moles de H+ ont été consommé par les moles de OH- pour donner de l'eau
Il reste dans la solution l'acide faible : CH3CH2COOH
On calcul donc le pH avec la formule de l'acide faible:
PH = 1/2 (Pka - log Ca) = 1/2(4.8 - log (0,2)) = 2.7
15 ml :
Après reaction avec H+, il reste 0.005 mol de HO-, qui vont reagir avec l'acide faible
Tableau d'avancement img 3
PH solution tampon : pH = pKa + log (Cb/Ca) = 4.8
20 ml :
Après reaction avec H+, il reste 0.01 mol de HO-, qui vont reagir avec l'acide faible
Tableau d'avancement img 4
PH base faible = 7+ 1/2*pKa + 1/2 log Cb = 7+ 1/2*4.8 + 1/2*2 = 8.4
Est-ce correcte ?
Si oui j'ai encore une question
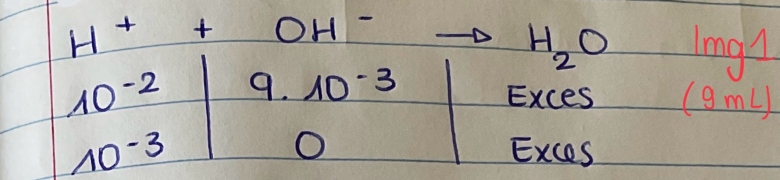
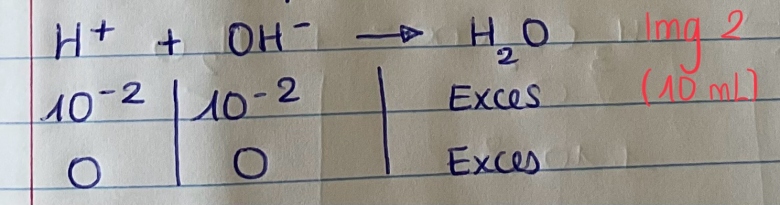
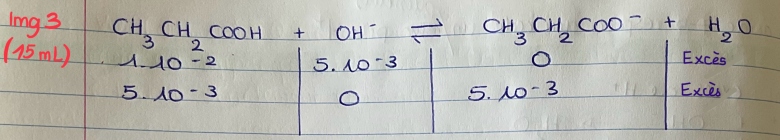
Tu progresses !
9mL : OK
10mL : tu as effectivement une solution d'acide faible. Deux remarques :
1° : le calcul de Ca doit tenir compte du volume total 110mL même si l'influence du volume de soude est faible pour la partie gauche de la courbe.
2° : tu utilises une formule que l'on peut sans doute dans ton programme considérer comme une formule de cours à condition d'en connaître exactement les deux conditions de validité à vérifier dans chaque cas. Même remarque pour 20mL. Ces justification utilise la notion de domaine de prédominances. Notion extrêmement importante ici. Demande à ce sujet des précisions si tu le juges utile.
15mL : il s'agit de la demie équivalence. Un tableau d'avancement conduit à [CH3COOH]=[CH3COO-] donc pH=pKa. Les notations ici Ca et Cb sont malheureuses.
2° : tu utilises une formule que l'on peut sans doute dans ton programme considérer comme une formule de cours à condition d'en connaître exactement les deux conditions de validité à vérifier dans chaque cas. Même remarque pour 20mL. Ces justification utilise la notion de domaine de prédominances. Notion extrêmement importante ici. Demande à ce sujet des précisions si tu le juges utile.
Je veux bien des precisions s'il vous plait
Je te répondrai ce soir pour les domaines de prédominances. D"ici là, si tu as un peu de temps, corrige tes calculs pour 10 et 20mL en tenant compte du volume total.
Pour répondre à tes questions sur les domaines de prédominances, tu peux consulter le site suivant. Il est clair et très rigoureux sur les notations et, me semble-t-il, bien adapté à tes préoccupations.
Tu pourras cliquer dans la partie gauche de l'écran sur les rubriques :
"Domaine de prédominance" puis : "diagramme de distribution".
Je te conseille cependant de prendre le temps de lire et comprendre toutes les rubriques.
![]()
A titre d'application directe, si tu as le temps bien sûr, tu pourrais t'entraîner à calculer les pH des solutions suivantes :
solution aqueuse d'acide éthanoïque à concentrations :
Ca=10-2 puis 10-4 puis 10-6mol/L
(pKa du couple : 4,8)
solution aqueuse d'ammoniac à concentrations :
Cb=10-2 puis 10-4 puis 10-6mol/L
(pKa du couple : 9,2)
Merci pour votre reponse j'ai corriger mes reponses :
10 ml : c = n/V = 0.01 / 0.11 =0.091
PH = 1/2 (Pka - log Ca) = 1/2(4.8 - log (0.091)) =2.9
20 ml : c = n/V = 0.01/0.12 = 0.083
PH= 7+ 1/2*pKa + 1/2 log Cb = 7+ 1/2*pKa + 1/2 log (0.083) = 8.85
Tes réponses sont correctes maintenant.
Comme déjà dit concernant les formules permettant de calculer le pH des solutions d'acide faible ou de base faible, il faut en vérifier les conditions de validité . Elles sont au nombre de deux... Mais j'aimerais, avant d'expliquer comment procéder, que tu aies bien compris la notion de domaines de prédominances... Je te laisse étudier le document que je t'ai fourni. N'hésite pas à poser des questions complémentaires si tu le juges utile.
Bonjour,
Voici ce que j'ai appris concernant les diagramme de predominance :
Pour les couples AH/A- en équilibre, l'acide et la base seront présents dans la solution mais l'une des deux forme sera presente en quantité majoritaire en fonction du pH
La relation pH = pKa + log (Cb/Ca) relie le pH au pKa.
Pour tracer un diagramme de predominance il faut :
- tracer une flèche representant l'echelle de pH
- Placer 0 (pH minimum), 14 (pH maximum) et le pKa
- Avant le pKa (cad pH < pKa) c'est la forme AH qui est presente en quantité majoritaire ; l'acide predomine
- Apres le pKa (cad pH > pKa) c'est la forme A- qui est presente en quantité majoritaire ; la base prédomine
- Lorsque le pH = pKa, l'acide et la base sont present en quantité égale
Img
Quelles sont les deux condition de validité ?
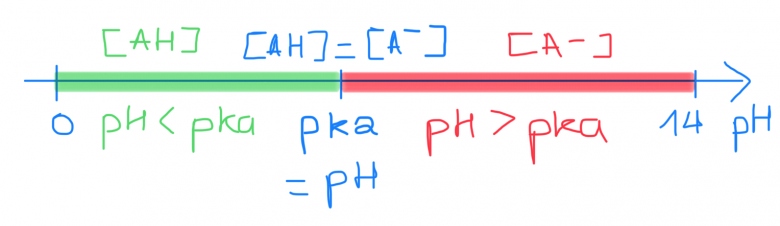
Tu as résumé l'essentiel sur le diagramme de prédominance. Tout repose sur la formule :
où A est un acide et B sa base conjuguée. S'il y a une formule importante à retenir : c'est bien celle-là ! Elle est valide pour tout couple acide fable/base faible présent en solution aqueuse diluée.
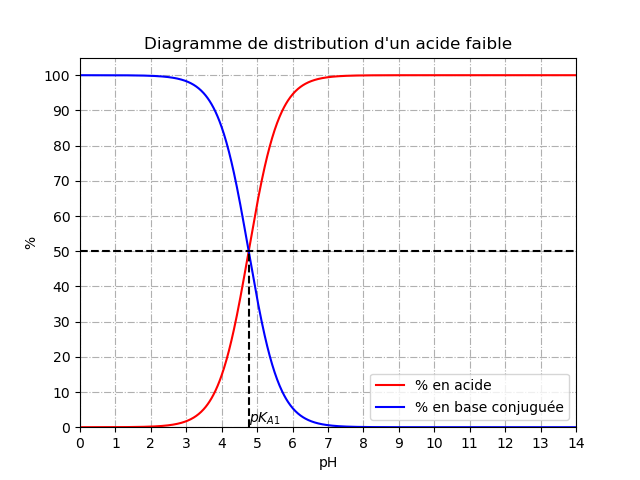
Le diagramme de distribution est aussi important. Les explications précises sont sur le document internet que je t'ai fourni. Je le reproduis ci-dessous avec des graduations plus précises. On y retrouve les domaines de prédominance étudiés précédemment mais on constate aussi que :
*si pH>pKa+1 : [B]>10[A] : près de 100% de l'espèce introduite est présente sous forme de base et il est possible de négliger la présence de l'acide.
* si pH<pKa-1 : [A]>10[B] : près de 100% de l'espèce introduite est présente sous forme d'acide et il est possible de négliger la présence de la base.
*si pKa-1 pH
pH pKa+1 : aucune des deux espèces n'est en quantité négligeable. Cela présage des calculs plus compliqués !
pKa+1 : aucune des deux espèces n'est en quantité négligeable. Cela présage des calculs plus compliqués !
Prenons maintenant une solution d'acide faible noté AH de concentration Ca.
Première hypothèse simplificatrice : l'autoprotolyse de l'eau est négligeable : cela suppose de trouver par la suite pH<6,5. La réaction prépondérante étant :
AH +H2O = A- + H3O+
tableau d'avancement en raisonnant sur les concentrations :
| Espèces chimiques | AH | H2O | A- | H3O+ |
| Quantités introduites par litre (mol/L) | Ca | Excès | 0 |  0 0 |
| concentrations à l'équilibre (mol/L) | Ca-h | Excès | h | h |
Constante d'équilibre de la réaction :
Deuxième hypothèse simplificatrice :
l'acide est suffisamment faible pour être très peu dissocié dans l'eau :
[AH]
 Ca. Cela simplifie l'équation précédente qui devient :
Ca. Cela simplifie l'équation précédente qui devient :
Puisque cette formule suppose l'acide très peu dissocié, cela suppose, comme montré au début du message : pH<pKa-1
Les voilà tes deux conditions ! Mais, pour comprendre, il faut avoir compris la démonstration... Attention à la tentation d'accumuler des formules sans trop les comprendre et surtout sans connaître avec précision leurs conditions de validité.