Inscription / Connexion Nouveau Sujet
Thermodynamique : Formule de Clapeyron
Bonsoir à tous !
Voilà, je dispose de l'énoncé suivant :
"La formule de Clapeyron s'écrit de la manière suivante : (voir image)
Moyennant trois hypothèses à rappeler, cette équation peut être intégrée et conduire à une relation simple entre p* (je suppose qu'il s'agit de la pression de vapeur saturante) et T, de la forme ln( p* ) = a/T + b.
Déterminer cette relation."
Je ne vois pas comment faire... Je ne maîtrise pas totalement cette partie de cours :S
Quelqu'un pourrait-il m'aider SVP ?
Merci d'avance à celles et ceux qui prendront la peine de m'aider 
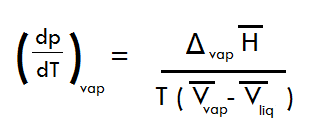
approximations usuelles :
- Vliq negligeabledevant Vgaz
- gaz parfait donc V gaz = RT/P ( volume d'une mol de gaz )
- deltaHvap est indépendante de la température ( sur un intervalle de température pas trop grand) . on pose deltaHvap = L
donc dP/dT = L /(RT/P) = L/R P/T^2
donc dP/P = L/R dT/T¨2 ce qui s'intègre par LnP = - L/R 1/T + cste ...



