Inscription / Connexion Nouveau Sujet
Thermodynamique : énergie de liaison C=O
Bonjour,
Je n'arrive pas à faire un exercice de thermodynamique. J'ai essayé de faire un cycle mais je ne sais pas si il est correcte. J'aurais besoin de votre aide, s'il vous plaît.
Merci d'avance
Enoncé
Connaissant l'enthalpie de formation f(CO2(g))= -393.5 kJ/mol qui correspond à l'enthalpie de la réaction :
C(graphite) + O2 CO2 (g)
l'enthapie de sublimation sublimation(Carbone) = 718 kJ/mol qui correspond à l'enthapie de formation de la réaction Cgraphite
C (g)
l'énergie de liaison EO=O= -497 kJ/mol qui correspond à l'enthalpie de la réaction O(g) + O(g) O2 (g)
Déterminer l'énergie de liaison EC=O qui correspond à l'enthalpie de la réaction C(g) + O(g) C=O (g)
J'ai essayé de faire un cycle de Hess mais je n'en suis pas sur.
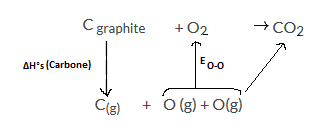
Bonjour
Je me demande s'il ne manque pas une donnée : l'enthalpie standard de la réaction d'oxydation du monoxyde de carbone en dioxyde de carbone :
CO(g) + ½O2(g)  CO2(g)
CO2(g)
C'est donc un oubli du concepteur de cet énoncé. Pour la réaction dont je t'ai fourni l'équation, les tables fournissent à 25°C :
 rH°=-283kJ/mol.
rH°=-283kJ/mol.
Il faut envisager la réaction :
C(graphite) + O2(g)  CO2(g)
CO2(g)
Pour laquelle la variation d'enthalpie est connue. Tu imagines alors un autre chemin pour aller du même état initial au même état final :
C(graphite) + O2(g)  C(g)+2O(g)
C(g)+2O(g) CO(g)+O(g)
CO(g)+O(g) ....
....  CO2(g)
CO2(g)
La somme des variations d'enthalpie par cet autre chemin doit être égale à celle obtenue par le premier chemin.
Attention aux signes : une énergie de liaison est comptée toujours positivement : c'est l'énergie qu'il faut fournir pour détruire une mole de liaisons.
Tu vas constater que l'indication que je viens de te fournir est indispensable. Je te laisse terminer. Tu devrais aboutir à une énergie de liaison de 1077kJ/mol.


