Inscription / Connexion Nouveau Sujet
Thermodynamique
Bonjour à tous,
J'ai un exercice de thermodynamique que je dois résoudre j'aurais besoin d'un peu d'aide
Une machine thermodynamique fonctionne selon un cycle ABCDA décrit comme sur le diagramme de Clapeyron suivant où toutes les transformations sont réversibles.
Trois moles de gaz parfait sont amenées de l'état A à l'état B par une transformation adiabatique réversible. La transformation de C à D est aussi adiabatique réversible.
Données :
PA= 1 bar
TA = 20°C
PB = 2 PA
R=8,314 J.mol-1.K-1
y=1.4
La première question est : calculer le volume à l'état A
Pv=nRT
V=0,073 m3
2) Calculer le volume à l'état B
C'est ici que je bloque je ne vois pas comment faire
3) Calculer la température Tb
Tb = PBVB / nR
Merci pour votre aide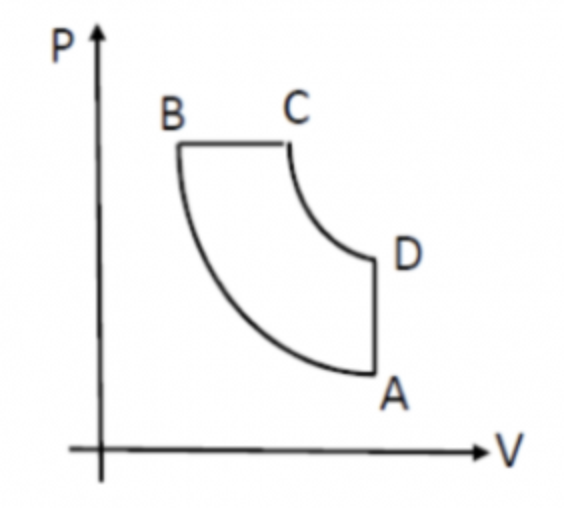
Bonjour Yelp, tu n'es pas nouveau sur notre forum, tu sais qu'il faut recopier ton énoncé texte d'exercice : merci donc de corriger cela (rafraîchis la page web pour avoir la figure recadrée).
Ensuite, ton profil affiche que tu es en première => merci de le mettre également à jour.
------
Un membre actif pourra venir t'aider ensuite.
Bonjour
La loi de Laplace sur les gaz parfaits : cela te parles ?
Des exercices analogues sont résolues sur la fiche sur le premier principe publiée sur le forum et aussi disponible en pdf ici, paragraphe 7 :![]()
***Edit gbm : lien vers les fiches du supérieur : ![]() [lien]***
[lien]***


