Inscription / Connexion Nouveau Sujet
Thermodynamique
Bonsoir, je suis en pleine période de révisions.. Et je bloque sur cet exercice pouvez vous m'aider s'il vous plait ? J'ai essayé de faire deltaH=chaleur spécifique x masse mais ça ne marche pas car je n'ai pas de variation de température dans l'énoncé....
Quelle est la quantité de chaleur nécessaire
a) pour décomposez 180 grammes d'eau liquide ou d'eau vapeur en O2(g) et H2(g) à 298K dans les conditions standards ?
b) pour vaporisez 180g d'eau liquide à 323K.
Bonsoir
Si la réaction se déroule à température fixe et sous pression extérieure fixe P=P°=1bar, la quantité de chaleur échangée lors de la réaction s'écrit :
où désigne l'avancement de la réaction (ici 10moles) et
l'enthalpie standard de réaction à 298K
La valeur de cette enthalpie standard de réaction n'est pas la même selon que l'eau est à l'état de liquide ou de vapeur... J'imagine que tu as des tables thermodynamiques à ta disposition...
Merci beaucoup.
Du coup pour le a) je trouve: 2858kj pour l'eau liquide et 2418 pour l'eau gazeuse.
Concernant le b) j'ai essayé de faire avec le delta cp et l'intégral mais je ne parviens pas à trouver la bonne réponse, j'arrive sur -189.125 en ayant fait 44+(323-298)x(-9.325).. 
D'accord avec toi pour le a)
Pour le b), difficile de te conseiller efficacement sans connaître les tables thermodynamiques à ta disposition. Tu as sans doute des renseignements sur l'enthalpie massique de vaporisation (parfois appelée chaleur latente massique de vaporisation) mais celle-ci dépend de la température et sans savoir à quelle température elle -t'es fournie, difficile d'élaborer une stratégie... Tu devrais obtenir, selon les tables à ma disposition, environ 429kJ...
Attention : Joule est le nom d'un scientifique : le symbole de l'unité est une majuscule.
Merci pour l'aide mais je ne parviens pas à faire le calcul... avec l'intégral, je pense que je n'ai pas bien compris la formule?
pour le delta Hr T1 j'ai fais : delta H eau liquide - delta H eau vapeur et j'ai trouvé 440kJ/mol
ensuite pour le delta Cp j'ai trouvé : 75.40-34.23 = 41.17
Pour le calcul j'ai fais :
440+(323-298)x41.17 =1469.25 kJ/mol..
La valeur ne correspond pas du tout à ce que vous m'avez dit je suis perdue ça m'inquiète de ne pas savoir le faire l'examen approche 
Méthode possible : imaginer le cycle suivant ; puisque l'enthalpie est une fonction d'état, la somme des quatre variations d'enthalpie est nulle.
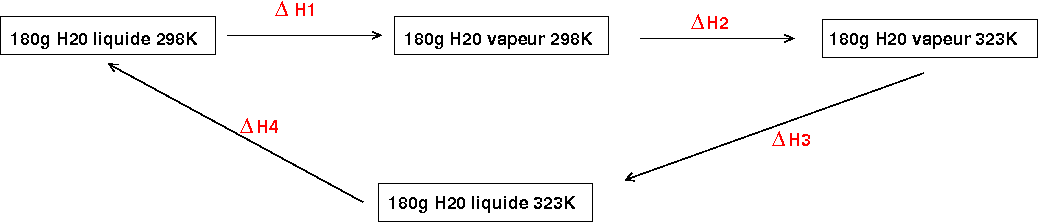
Merci pour l'explication, j'arrive à mieux visualiser, mais je ne comprends toujours pas comment vous faites pour atteindre 429 kJ/mol en réfléchissant comme avec votre graphique je trouve :
(323-298)x 41.17 = 1029 kj/mol
Je crois que tu t'embrouilles un peu avec les différentes grandeurs : grandeurs molaires (en kJ/mol) , variations d'enthalpie (en kJ).
L'enthalpie molaire de vaporisation de l'eau à T1=298K vaut 44kJ/mol. Puisque le système étudié contient 10 mol d'eau, la variation d'enthalpie de l'eau lors de sa vaporisation à 298K vaut 440kJ.
Les tables à ma disposition indiquent :
capacité thermique molaire de la vapeur : 33,6J.K-1.mol-1. La capacité thermique de 10moles de vapeur est donc : Cpv=0,336kJ/K.
capacité thermique molaire du liquide : 75,3J.K-1.mol-1. La capacité thermique de 10moles de liquide est donc : CpL=0,753kJ/K.
Je reprends le schéma précédent :
 H1=440kJ
H1=440kJ
 H2=Cpv.
H2=Cpv. T=0,336*25 kJ
T=0,336*25 kJ
 H3=-
H3=- Hv,323 (l'inconnue du problème)
Hv,323 (l'inconnue du problème)
 H4=-CpL*
H4=-CpL* T=-0,753*25 kJ
T=-0,753*25 kJ
En écrivant que la somme des variations d'enthalpie sur le cycle est nulle, on obtient :
 Hv,323=440+0,336*25-0,753*25
Hv,323=440+0,336*25-0,753*25 429kJ
429kJ
Merci beaucoup pour vos explications, j'ai réappliqué votre méthode sur d'autres problèmes et je parviens un peu mieux, mais du coup nous n'avons pas besoin de résoudre une intégrale? Parce que lors des séances d'exercices, l'assistante le faisait de cette façon..
mais du coup nous n'avons pas besoin de résoudre une intégrale?
Tout dépend du niveau de précision souhaité... De plus en plus souvent, pour privilégier la compréhension par rapport à l'aspect "calculatoire" des problèmes, on fournit les valeurs moyennes des capacités thermiques sur l'intervalle de température étudiéé de façon à pouvoir poser, par exemple :
 H2=Cpv.
H2=Cpv. T=Cpv.(T2-T1).
T=Cpv.(T2-T1).
Si on souhaite une meilleure précision, on tient compte des variations des capacités thermiques en fonction de T et il faut utiliser le calcul intégral :
Tout dépend de l'énoncé !


