Inscription / Connexion Nouveau Sujet
Thermochimie 3
Bonsoir,
C'est moi encore je cherche une aide pour débuter.
La glycolyse est la coupure enzymatique d'une molécule de glucose en deux molécules d'acides lactique selon la réaction :
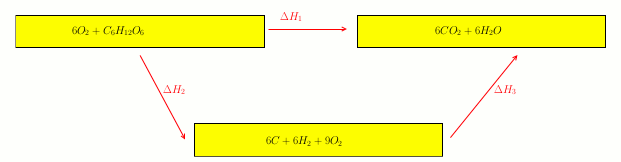
1) Écrire la réaction de combustion du glucose et de l'acide lactique, sachant que l'on obtient du dioxyde de carbone gazeux et de liquide.
2) Calculer les enthalpies molaires standards de formation du glucose solide et de l'acide lactique liquide.
3) Calculer l'enthalpie molaire standard de cette réaction (on négligera les effets thermiques associés à la dissolution lors de la formation de glycolyse)
Données :
| KJ/mol | |
| combustion de 1 mol de C6H12O6(s) | -2816 |
| combustion de 1mol de C3H6O3(s) | -1364 |
| Enthalpies de formation de CO2 (s) | -394 |
| Enthalpies de formation de H2O (l) | -286 |
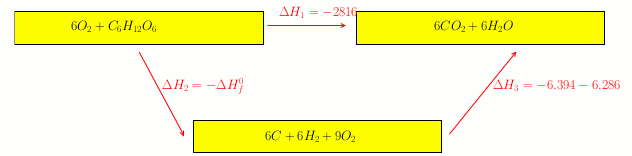
Schéma plus lisible avec quelques compléments utiles. Je te laisse réfléchir.
Les données numériques sont en kJ/mol.
Bonjour,
En fait je pense que je vien de comprendre.
est l'enthalpie de la réaction de combustion, qui est donné dans l'énoncé.
On cherche l'enthalpie standard de formation du glucose qui est
Est-ce que j'ai compris ?