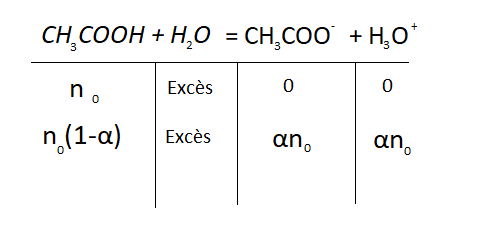Inscription / Connexion Nouveau Sujet
Taux de dissociation
Bonjour,
Ce petit exercice de chimie me pose bien des problèmes,
Sachant que le taux de dissociation de l'acide éthanoïque de concentration est
.
Déterminer la constante d'équilibre de la réaction :
J'ai fait mon tableau d'avancement et je trouve
Ou bien si je remplace
par
Mais dans tous les cas il me manque soit la valeur de ou du pH pour terminer mon calcul

Merci pour votre aide
Bonjour
Je ne crois pas que no intervienne. As-tu rempli un tableau d'avancement en négligeant l'influence de l'autoprotolyse de l'eau ? Il faut exprimer chaque concentration en fonction de co et de  et porter dans l'expression de K.
et porter dans l'expression de K.
Merci pour votre réponse c'est vrai que j'ai négligé l'autoprotolyse mais voici mon tableau ci dessous.
Je ne vois pas comment ne pas utiliser ... Je peux certes le remplacer par
mais je n'aurai toujours pas de volume donné ...
Encore merci pour votre aide