Inscription / Connexion Nouveau Sujet
Structure de Lewis
Bonsoir à tous.
J'aimerai avoir un explication sur la résonance. J'ai fait des recherches mais je n'arrive pas à comprendre grande chose.
Ok merci bien. J'ai compris un bon nombre de choses. Cependant, je ne sais pas à quoi renvoie ces trois barres, les pointillés et les 1/2.
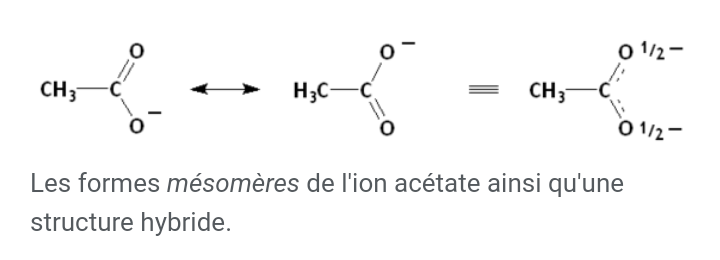
Les propriétés de l'ion acétate peuvent s'interpréter comme étant intermédiaires entre celles des deux formes mésomères. Autre façon équivalente de présenter les choses (équivalence symbolisée par les 3 traits dont tu parles): les deux électrons de la liaison  et l'électrons excédentaire responsable de la charge négative de l'ion sont délocalisés, c'est à dire qu'il peuvent se déplacer sur l'ensemble des trois atomes O-C-O. Cette délocalisation est symbolisé par les pointillés dont tu parles. Ainsi, au lieu d'avoir une charge "-" localisée sur un atome O déterminé, la délocalisation des électrons fait que chaque atome O porte en moyenne une charge -1/2.
et l'électrons excédentaire responsable de la charge négative de l'ion sont délocalisés, c'est à dire qu'il peuvent se déplacer sur l'ensemble des trois atomes O-C-O. Cette délocalisation est symbolisé par les pointillés dont tu parles. Ainsi, au lieu d'avoir une charge "-" localisée sur un atome O déterminé, la délocalisation des électrons fait que chaque atome O porte en moyenne une charge -1/2.
Autre exemple classiques de liaisons délocalisées : la molécule de benzène : ![]() .
.


