Inscription / Connexion Nouveau Sujet
structure de lewis
Bonjour à tous,
J'ai une petite question quant à la structure de Lewis de
L'aluminium ayant 3 électrons de valence, je ne vois pas trop d'ou provient l'électron qui sert à former la 4 ème liaison. J'ai pensé au départ qu'il provenait de l'atome de fluor mais dans la structure de Lewis, l'atome de fluor ne fournit qu'un seul électron ...
Bonjour,
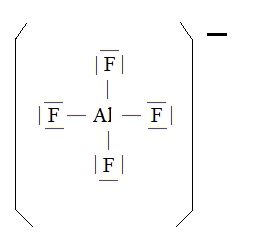
Faisons les comptes pour la structure AlF4-
1 atome Al soit 3 électrons de valence
4 atomes de Fluor soit 4*7 = 28 électrons de valence.
1 électron supplémentaire puisque la structure AlF4- n'est pas électriquement neutre.
Total : 3 + 28 + 1 = 32 électrons de valence et donc 16 doublets.
Ces 16 doublets se répartissent en :
4 doublets liants entre Aluminium et les 4 Fluors
12 doublets non liants répartis régulièrement sur les 4 Fluors.
La règle de l'octet est respectée pour tous les éléments.
Bonjour
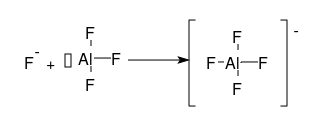
Commence par raisonner sur la molécule AlF3 schématisé ci-dessous :
Les trois électrons de valence de l'atome Al établissent trois liaisons de covalence simples avec 3 atomes de fluor (le fluor est monovalent)
La règle de l'octect n'est pas vérifiée pour Al : il manque sur sa couche de valence un doublet d'électrons : on parle de lacune électronique, parfois symbolisé par un petit rectangle vide.
Pour vérifier la règle de l'octect, Al peut se lier à un ion fluorure F- : cet ion possède un doublet électronique sur sa couche de valence qu'il va partager avec l'atome Al, établissant ainsi une quatrième liaison covalente. Une fois établie, cette liaison a les même propriétés que les trois autres mais son mode d'établissement est différents : les deux électrons de liaison sont fournis par le même atome : on parle de liaison covalente de coordination (on parlait autrefois de liaison covalente dative).