Inscription / Connexion Nouveau Sujet
Spectrosopie de Masse
Bonjour ! Voici l'énoncé de mon exercice :
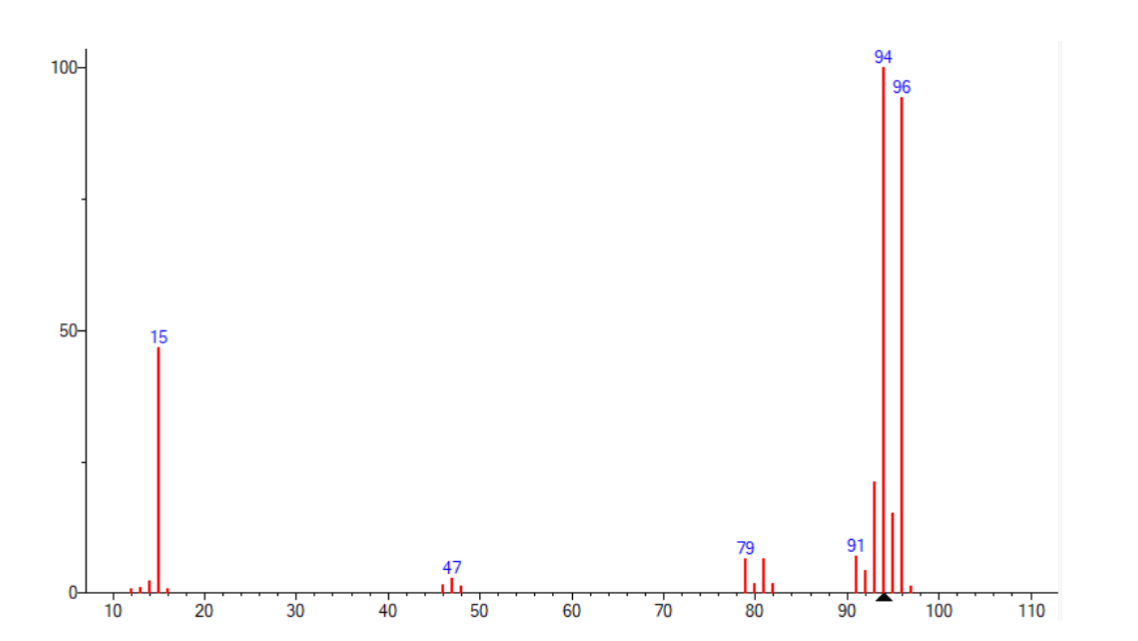
En ionisation électronique (EI) on obtient le spectre suivant. Sachant que ce composé contient du Carbone et de l'Hydrogène et son M+. est observé à m/z 94 et en vous basant sur la distribution isotopique proposez une formule élémentaire et un composé.
Mon raisonnement :
Si nous appliquons un « raisonnement de chimiste », dans l'énoncé on nous dit que le composé recherché est un composé organique qui contient donc du Carbone et de l'hydrogène-> donc c'est un hydrocarbure. On nous dit également que la masse du composé est de m/z = 94 u. Donc logiquement, on pourrait essayer de trouver le composé avec les masses moléculaire de manière « logique ». En effet, 1C = 12 u et 1H = 1 u.
On veut donc déterminer le maximum de Carbones possibles présent dans 94 u. (règles des 12)
#Max carbones = 94u/12u = 7,8 environ donc 7 carbones. C'est impossible que ce soit 8 car 12*8 = 96> 94 u.
#Max Hydrogènes = On sait que 12*7 = 84 u donc 94-84 = 10 u donc 10 atomes d'Hydrogènes.
-> Donc c'est C7H10 qui correspond à bien à un hydrocarbure : le Norbornène
Sauf que je crois que c'est pas ça que il faut faire, il faut le faire avec une méthode spectroscopique de masse avec les abondances relatives du 12C ou 13C (1,1% ; 88,2%) avec le M et M+1...
quelqu'un pourrait m'aider ? 
Merci d'avance,
Zohra
Bonsoir,
En effet ton raisonnement n'est pas bon pour l'analyse de spectre de masse. En effet, hydrocarbure ne veut pas dire linéaire ! Il peut avoir toutes sortes de ramifications possibles. Pour connaitre la structure, il faut analyser les pics et les déduire les fragments (surtout en impact électronique!).
Sauf que je crois que c'est pas ça que il faut faire, il faut le faire avec une méthode spectroscopique de masse avec les abondances relatives du 12C ou 13C (1,1% ; 88,2%) avec le M et M+1...
Oui il faut procéder de cette manière, as-tu une idée ?
Si nous identifions comme le rapport m/z = 94 u = M, alors lui il est présent à 100%.
Et si on prend M+1, c'est 95 et il est présent à environ 16%
Si on applique la formule :
#Carbone = (16/100)*(100%/1,1%)
-> 1,1% car le 13C est présent à environ 1,1% chaque 100 atomes
on trouve un résultat totalement aberrant comme 14 Carbones alors que c'est impossible puisque ça ferais 12*14> 94 u !
Bonsoir,
Attention, il faut regarder les intensités relatives !
En M+1 on n' a pas une intensité de 95 mais plutôt de 14,5 environ.
Soit Nc x 1,1 = 15 avec Nc le nombre de carbone.
Donc on a bien une molécule à 14 carbones.
Maintenant il s'agit de déduire le composé. Si tu propose une structure linéaire, il faut que ce soit en accord avec les autres pics de fragmentation (pics à 15, 47 et 79 m/z).