Inscription / Connexion Nouveau Sujet
spectres de l'atome d'hydrogène
Le diagramme ci dessous illustre la disposition relative des 6premiers niveaux d'énergies de l'atome d'hydrogène dans le modèle de bohr.Soit En l'énergie du niveau n. Pour un atome isolé on donne E2= -5,436*10-19 J.
1) On me demande de calculer E3,E5 et E6 en joules et en eV.
2) Les 3 transitions electroniques (a),(b)et (c) correspondent à l'émission de 3 radiations par un atome de H isolé. Calculer  a,
a, bet
bet  c.
c.
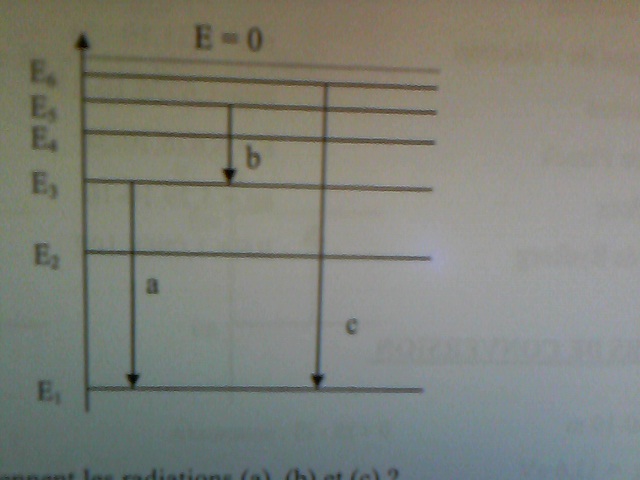
Je trouve E3= -13,6*(1/9)=-1,51 ? es-ce correcte ? l'unité est-elle le joule ? si oui comment passer en eV ?
a) Pour l'atome d'hydrogène, l'énergie du niveau n est donnée par : En=-E1/n2
b) La longueur d'onde d'une radiation est reliée à la différence d'énergie entre les niveaux initial et final :  E=hc/
E=hc/
z2 intervient pour les ions hydrogénoïdes (qui n'ont qu'un seul électron). Ici pour l'hydrogène Z=1 donc En=-k/n2
L'énoncé donnant la valeur de E2, vous pouvez donc en déduire la valeur de k puis les valeurs des autres niveaux d'énergie en utilisant la formule En=-k/n2
J'ai fait une erreur de signe dans la formule que je vous ai donné, en effet : En=+E1/n2 car E1=-k/1=-k


