Inscription / Connexion Nouveau Sujet
solvant-soluté
Bonjour,
si on a par exemple la réaction:
(NH4+)+(H2O)->NH3 +H3O+
1ère question: si le solvant est l'eau, les (?) solutés sont H30+, NH4+, NH3 ?
Si le solvant est l'eau alors:
K = [NH3]*[H3O+]/[NH4+] car l'activité de l'eau est 1 puisque la solution est diluée et l'eau est le solvant.
Si le solvant est NH4+,
K = [H3O+]*[NH3]/[H20], a(NH4+)=1
2ème question: pourquoi K est différent si on considère des solutés/solvant différent alors qu'on a la même réaction?
Je dois avoir un problème de vocabulaire...
Merci!
Bonsoir,
Non, tu n'as pas de problèmes de vocabulaire.
Tu dois savoir que les constantes sont exprimées par rapport aux activités des espèces présentes dans le milieu selon la formule :
K = 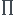 ai
ai i
i
avec ai activité de l'espèce i et  i son coefficient stoechiométrique.
i son coefficient stoechiométrique.
Couramment, on se place dans les conditions où l'on peut considérer que l'activité de l'espèce est égale à sa concentration et que les solutions sont aqueuses. Ainsi l'eau étant en excès, son activité est posée égale à 1.
[Voir ces liens Wikipédia pour plus d'informations :
 Constante d'équilibre :
Constante d'équilibre : ![]()
 'Lien entre Activité chimique et concentration' :
'Lien entre Activité chimique et concentration' : ![]() ]
]
Maintenant, si tu considères, par exemple, une réaction d'estérification qui libère de l'eau... L'eau n'étant pas le solvant (surtout pas sinon, pas d'ester formé), alors tu doit considérer la concentration en eau dans ta constante.
C'est donc tout à fait 'légitime/normal' que les constantes aient des valeurs différentes en fonction du solvant puisque, mathématiquement, elles n'ont pas la même expression !
Et d'autant plus que les constantes d'équilibre dépendent également de la température !
ok mais dans la réaction que j'ai donnée l'eau n'est pas en excès et s'il n'y en a pas, il n'y a pas de réaction?
Oui mais dans ce cas, va calculer la concentration de l'eau ! 
Personnellement, je n'ai jamais rencontré NH4+ et H3O+ ailleurs que dans de l'eau ! 
Dans la pratique, on était toujours en solution aqueuse...
Par exemple, ou plutôt C(eau) = n(eau) formé / Vsolution... si ton solvant n'est pas de l'eau...
Et à condition que l'eau soit soluble dans ton solvant !
Bref, là, ça sort du cadre de mes compétences... Honnêtement, ne te prend pas trop la tête avec ça, les réactions sont (quasiment) toujours aqueuses car l'eau est un excellent solvant !
Et puis, si l'eau est "gênante" comme dans un estérification, alors on s'arrange pour s'en débarrasser (Dean-Stark par exemple) et augmenter le rendement...
Et vu que de l'eau représente environ 75% de notre planète, c'est pas elle dont on va calculer les quantités de matières vu que ce n'est pas le produit que l'on souhaite formé ! 


