Inscription / Connexion Nouveau Sujet
Solubilité du sulfate de strontium
Bonjour, ayant des lacunes en chimie j'aurais besoin de votre aide afin de développer mon raisonnement. Merci d'avance de votre aide.
Voici l'énoncé :
La solubilité de sulfate de strontium SrSO4 dans l'eau pure, à 20 degré vaut s0=135 mg.L-1. Donnez l'equation-bilan de la dissolution de ce solide.
2.donnez l'expression et calculez la valeur du produit de solubilité Ks de SrSO4.
3. On introduit 10 mg de SrSO4 dans 10 ml d'acide sulfurique de concentration Co=10mol.l-1. On agité suffisamment longtemps pour dissoudre tout le solide. Calculez la concentration finale en ions SO42-. La concentration finale en ions Sr2+, et la masse de sulfate de strontium non dissous.
Donnée M (SrO4)=183,7g.mol-1
1. SrSO4->SO42-+Sr2+
2.Ks=[SO42-][Sr2+]=s2
Ks=(0,135)2=1,82×10-2mol.l-1
Soit solubilité massique de 3,34334 g.l-1
3.n (Zn)==5,44×10-5mol
Soit C (Zn)==5,44×10-4 mol.l-1
Ci==5,44×10-4
On trouve xe=1 mol
Mais c'est faut car en le remplaçant pour SrO4 dans le tableau d'avancement on obtient -9,999 môle
Du coup je suis partis sur une autre piste.
Dans le tableau d'avancement C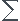 =1
=1
Ainsi :
1=
1×100×10-3(5,44×10-5-xe)
5,44×10-6-0,1xe=xe2
xe2-5,44×10-6-0,1xe
 =1,00×10-2
=1,00×10-2
X1 soit xe =1,00×10-1
Mais encore une fois je retrouve une concentration négatif quand je vérifie avec le tableau
Bonjour
Ks=(0,135)2=1,82×10-2mol.l-1
Ks fait intervenir les concentrations molaires, pas les concentrations massiques.
Un produit de solubilité, comme n'importe quelle constante d'équilibre, n'a pas d'unité.
La définition rigoureuse est, pour ce sel :
puisque c° est la concentration standard égale à 1mol/L, il est habituel de ne pas écrire les "c°" dans les équations mais il faut s'en souvenir pour ne pas attribuer d'unité aux constantes d'équilibre.
Je ne comprends pas bien la question n° 3 : l'as-tu recopiée intégralement ?
Donc du coup on a juste 1,82x10-2 comme ks de même que kc, kp sont sans unité c'est ça  ?
?
J'ai bien recopier intégralement la question 3. Je vous l'assure  .
.
Ce qui me gêne à la question 3 : il est d'abord écrit que tout le sulfate de strontium se dissout pour demander aussitôt après la masse non dissoute.
Je pense que la question est mal formulée ; j'aurais personnellement écrit :" On agite suffisamment longtemps pour arriver à une solution saturée, c'est à dire à un équilibre entre le solide non dissout et la solution".
la solubilité (solubilité molaire si tu préfères) est :
Produit de solubilité :
Pour la suite, le raisonnement ressemble beaucoup à un déjà fait. Les ions sulfate de la solution proviennent à la fois de l'acide sulfurique et de la dissolution de SrSO4. Cependant, SrSO4 étant très peu soluble, on peut considérer pour simplifier que la quantité d'ions sulfate due à la dissolution du solide est négligeable devant celle fournie par l'acide sulfurique. Cela conduit à :
l'ajout des 10mg de solide ne modifie pas sensiblement le volume donc ne modifie pas la concentration.
La solubilité de SrSO4 dans l'acide sulfurique est donc :
Remarque : la quantité par litre d'ions sulfate fournie par la dissolution de SrSO4 est donc égale à s ; elle est bien, comme cela a été supposé, très inférieure à celle fournie par l'acide sulfurique : 5,4.10-5 << 10-2.
La masse de sulfate de strontium dissoute est donc :
La masse restante de solide est donc :


