Inscription / Connexion Nouveau Sujet
solubilité de l'étain (II)
Bonsoir,
J'ai des difficultés à comprendre la correction de l'exercice suivant :
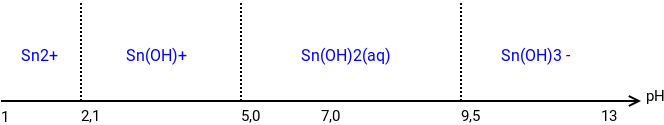
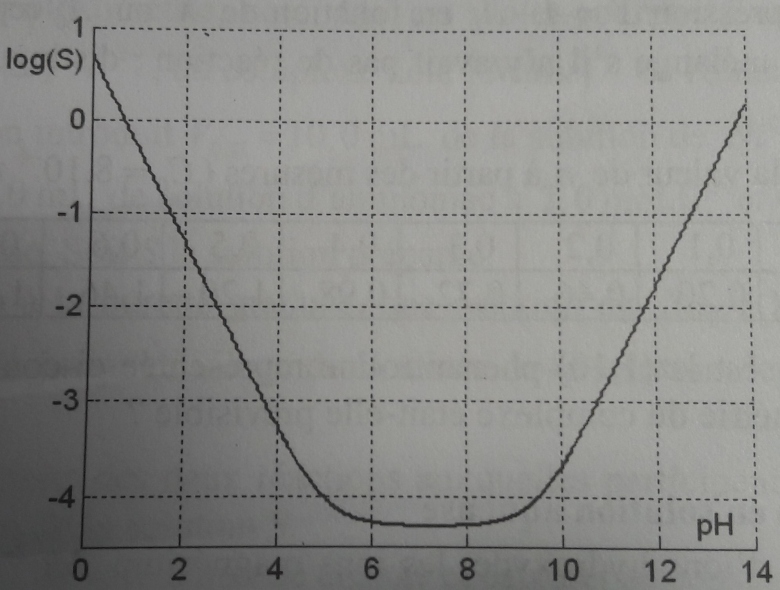
On donne le diagramme de solubilité de l'étain (II) en fonction du pH (cf image). Soit l'équilibre hétérogène Sn(OH)2(s)=Sn(OH)2(aq). On introduit 10-3mol de SnCl2 dans un litre d'eau. A cette solution on rajoute de la soude, l'apparition du précipité Sn(OH)2(s) a lieu à pH1 et sa disparition à pH2. Déterminer pH1 et pH2 graphiquement. Retrouver pH1 par le calcul. Déterminer la quantité de précipité pour pH=7,0, pH=10,0 puis pH=13,0.
Données :
pKA1(Sn2+/Sn(OH)+)=2,1
pKA2(Sn(OH)+/Sn(OH)2(aq))=5,0
pKA2(Sn(OH)2(aq)/Sn(OH)3(aq)-)=9,5
pKs(Sn(OH)2(s))=25,2
Voici ce qu'il y a écrit dans la correction et ce que je ne comprends pas est en gras:
Les pH d'apparition et de disparition du précipité se lisent à l'intersection de l'horizontale log S=-3 et de la courbe de saturation : pH1=3,7 et pH2=10,8.
Je vois bien comment on trouve log S=-3 mais je ne comprends pas pourquoi on lit les pH qu'on cherche à l'intersection entre logS=-3 et la courbe de saturation.
J'ai aussi du mal à comprendre comment on utilise ce genre de courbes de manière générale et à quoi elles servent (ce qu'elles permettent de trouver).
Ensuite il y a écrit : pH1 appartient au domaine de prédominane acido-basique de Sn(OH)+ soit à la limite d'apparition du précipité [Sn(OH)+]=10-3mol/L.
Ce que je ne comprends pas c'est que pour moi on a la réaction :
Sn2++H2O=Sn(OH)++H3O+ avec une constante qui est Ka1=10-2,1 qui est petite devant 1 donc la réaction est limitée donc on a [Sn(OH)+]=x avec x l'avancement et x=8,98.10-4mol/L et donc on a [Sn(OH)+]=8,98.10-4mol/L  10-3mol/L.
10-3mol/L.
Après, je me dis qu'étant donné qu'on est dans le domaine de Sn(OH)+ on peut peut-être considérer cette réaction comme totale ce qui pourrait expliquer le résultat de la correction. Est-ce que c'est bien cela ?
Enfin il y a écrit : à pH=7, le précipité est en équilibre avec la forme majoritaire Sn(OH)2(aq) avec [Sn(OH)2(aq)]=5.10-5mol/L
La quantité de précipité est n=10-3-5.10-5=9,5.10-4mol.
Je ne comprends pas pourquoi [Sn(OH)2(aq)]=5.10-5mol/L et je ne comprends pas non plus pourquoi n=10-3-5.10-5=9,5.10-4mol. (la correction ne donne que ce résultat tel quel il n'y a pas de résultat littéral mais juste cette application numérique)
Merci d'avance pour vos explications !
Bonjour
Il s'agit d'un problème assez classique sur les hydroxydes amphotères, assez compliqué tout de même puisque deux complexes sont susceptibles de se former au lieu de un le plus souvent. Tu pourrais peut-être consulter les documents sur le net expliquant l'influence du pH sur la solubilité de l'hydroxyde de zinc ou sur la solubilité de l'hydroxyde d'aluminium. Voir ici par exemple, paragraphe IV, pages 13 et suivantes : ![]()
Expérience simple. Imagine une solution très acide de chlorure d'étain à laquelle tu ajoutes progressivement une solution de soude de façon à augmenter progressivement le pH. Tu obtiens d'abord la formation d'un complexe soluble et incolore :
Sn2+ + HO- = Sn(OH)+
Rien ne se passe visuellement
Continue à ajouter de la soude. A partir d'un certain pH, noté pH1, le précipité blanc d'hydroxyde d'étain commence à se former selon la réaction :
Sn(OH)++HO- = Sn(OH)2(s)
Continue à ajouter de la soude : la quantité de précipité va peu à peu diminuer selon une nouvelle réaction formant un complexe incolore :
Sn(OH)2(s)+HO- = Sn(OH)3-
Le précipité n'existe plus à partir d'une valeur pH2 du pH.
La solubité du chlorure d'étain est la quantité maximale de ce solide qui peut être dissoute par litre. C'est donc la quantité dissoute lorsque la solution est saturée, c'est à dire lorsque la solution est en équilibre avec le solide. De façon générale, selon le pH, les ions étain passés en solution sont présent sous forme d'ions étain ou sous forme d'ions étain complexés. L'expression générale de s est ainsi :
s=[Sn2+ ]+[ Sn(OH)+]+[Sn(OH)3-]
Le concepteur de cet énoncé est sympa : il ne demande pas d'établir l'expression de s en fonction de h=[H3O+]. La courbe log(s) = f(pH) est fournie ; on constate comme expliqué qualitativement, un minimum de solubilité pour un pH un peu supérieur à 7.
pourquoi on lit les pH qu'on cherche à l'intersection entre logS=-3 et la courbe de saturation.
J'ai aussi du mal à comprendre comment on utilise ce genre de courbes de manière générale et à quoi elles servent (ce qu'elles permettent de trouver).
Suppose que tu introduises c mole par litre d'ions étain. Deux cas sont envisageables :
1er cas : s>c soit pH<pH1 et pH>pH2 : la solution peut dissoudre plus de soluté par litre qu'il en est introduit ; la solution reste donc limpide : pas de précipité.
2ième cas : s
 c soit pH1
c soit pH1 pH
pH pH2 : la quantité de solide introduite par litre est supérieure que la quantité susceptible d'être dissoute : on observe un précipité à l'équilibre.
pH2 : la quantité de solide introduite par litre est supérieure que la quantité susceptible d'être dissoute : on observe un précipité à l'équilibre.
Je te laisse réfléchir à tout cela. Pose de nouvelles questions si tu le juges utile.
P.S. Dans l'expression de la solubilité, j'ai oublié [Sn(OH)2(aq)] mais cela ne change pas le sens général de mon message précédent.
Dans le cas le plus général, la solubilité s'écrit :
Mais, selon le pH, certaines concentrations peuvent être totalement négligeables. Il faut tenir compte des domaines de prédominances que je rappelle ci-dessous. Je prends deux exemples (pas tout à fait au hasard...) :
pH = 3,7 : cette valeur est supérieure (pKa1+1) et inférieure à (pKa2-1) :
pH=10,8 : cette valeur est supérieure à (pKa3+1) :