Inscription / Connexion Nouveau Sujet
Sens d'évolution d'une réaction et constante d'équilibre
Bonjour,
Je suis complètement bloquée sur une partie de mon cours de thermo 
J'ai un exercice dans lequel on étudie l'équation suivante :
Glucose + Sérine --> (Glu-)Ser + H20
(avec en données :  rG° = -7 kJ.mol-1 et
rG° = -7 kJ.mol-1 et  rH° = 38 kJ.mol-1)
rH° = 38 kJ.mol-1)
Et voilà ensuite les questions (QCM)
B) Une augmentation de la concentration en glucose déplace la réaction dans le sens de formation de la liaison glycodisique.
D) L'utilisation d'un desséchant déplace la réaction dans le sens direct.
J'ai les corrections qui me disent :
Pour la B correct car si la concentration en glucose augmente alors la concentration en réactifs augmente ce qui déplace la réaction dans le sens direct.
Pour la D correct car une diminution de la concentration en eau entraine une diminution de la concentration en produits ce qui favorise le sens direct.
Et je n'arrive pas du tout à comprendre pourquoi dans les deux cas parce que quand j'essaie de raisonner je tombe sur : augmentation de la concentration en réactifs entraine une diminution de la constante d'équilibre K et donc devrait favoriser 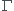 > K et donc le sens 2 et inversement pour une augmentation de la concentration en produit (augmentation de la concentration en produit entraine augmentation de la constante d'équilibre K et donc favorise
> K et donc le sens 2 et inversement pour une augmentation de la concentration en produit (augmentation de la concentration en produit entraine augmentation de la constante d'équilibre K et donc favorise 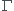 < K et donc le sens 1)
< K et donc le sens 1)
Voilà mon raisonnement est donc complètement faux mais si quelqu'un avait le temps de m'expliquer pourquoi ce serait génial  Merci d'avance !
Merci d'avance !
Tu confonds le quotient réactionnel que j'appelle Q ( que tu as l'air d'appeler grand gamma )et la constante d'équilibre K . Le quotient réactionnel est une grandeur instantanée qui peut prendre n'importe quelle valeur et il vaut K lorsque l'équilibre est établi . K ne dépend que de la température .
On a un équilibre Q=K . On ajoute un réactif alors Q diminue et devient inférieur à K . Il faut donc qu'il y ait évolution pour remonter Q donc sens direct .


