Inscription / Connexion Nouveau Sujet
Représentation de Lewis
Bonjour ou bonsoir , j'ai un exo et i y'a une question que je n'arrive pas à résoudre, pourriez-vous m'aidez svp
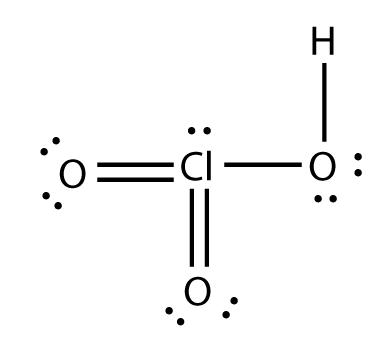
Je dois faire la représentation de Lewis et trouver le nombre d'oxydation de CLO3-. Je n'ai aucun problème à trouver des nombres d'oxydation mais je ne comprends pas pourquoi j'ai une mauvaise configuration de Lewis . Je sais que la bonne réponse est celle-là (1ère image) mais moi j'ai une représentation différente (2eme image) et je ne comprends pas pourquoi la mienne est fausse.
Pouvez vous m'aidez s'il vous plait ?
Finalement j'ai compris en faisant plusieurs autres exercices du genre...Merci quand même d'avance à ceux qui ont voulu m'aider
Pour qu'une structure de Lewis puisse être considérée comme correcte, il faut qu'elle rende compte au mieux des faits expérimentaux.
On sait par exemple que cet ion est la base conjugué de l'acide HClO3 dont la structure est rappelée ci-dessous. Avec ton autre modèle, l'ion H+ viendrait se lier à Cl et non à O. Le modèle de Lewis indiqué en position 1 est un des trois possibles : l'expérience montre aussi que les trois liaisons Cl-O sont équivalentes. La molécule résulte d'un équilibre entre les trois formules de Lewis possibles. On parle de liaisons délocalisées...
Tu verras plus tard que la théorie des orbitales atomiques et des hybridations de ces orbitales est en accord avec les faits expérimentaux.