Inscription / Connexion Nouveau Sujet
réaction et gaz N°2
Bonjour,
voici le second exercice qui me pose problème... faut il utiliser la relation des gaz parfait ? ou encore faire un tableau d'avancement ? je vous remerci beaucoup
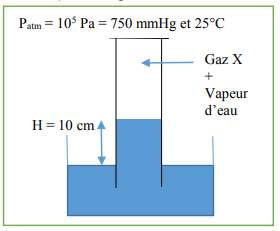
On récupère un gaz X sur une cuve à eau, comme ci-dessous :
a) Calculer la pression du gaz en Pa dans
l'éprouvette, sachant que la pression
atmosphérique est de 105 Pa et que la masse
volumique de l'eau est de 1,00 kg.dm-3
b) Calculer la pression partielle du gaz X,
sachant qu'à 25°C l'eau a une pression partielle
de 20 mm de mercure (ou Torr).
c) En admettant que le gaz X se comporte comme un gaz parfait, calculer la quantité de
matière de X (en mol) qu'il y a dans l'éprouvette de 250 mL.
et je pense que la 1) réponse est Pa-Pb= 1000*9,81*0,15 d'ou Pb = 99853 pa
pour le reste je ne sais point.
Bonsoir
La statique des fluides montre que la pression totale du gaz dans l'éprouvette est égale à :
P=Patm- eau.g.H
eau.g.H
avec ici :
H=0,10m. D'où vient ce 0,15 dans ton calcul.
Pour la suite, pour obtenir la pression partielle du gaz, il te faut soustraire à cette pression totale la pression partielle de la vapeur d'eau, celle-ci étant exprimée en pascals.
Tu appliques pour finir la loi des gaz parfaits au gaz X : celui-ci se comporte comme s'il était seul en occupant la totalité du volume du gaz sous une pression égale à sa pression partielle.



