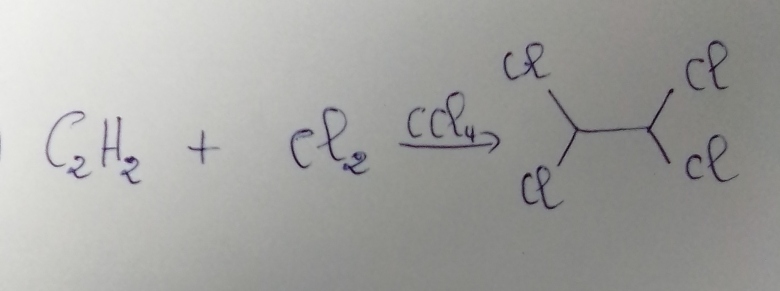Inscription / Connexion Nouveau Sujet
Réaction de l'acéthylène sur le dichlore.
Bonjour à tous merci d'avance.
En présence de catalyseur tel que le tetrachlorométhane , l'acéthylène réagit sur le dichlore.Il se forme du 1,1,2,2-tetrachloroéthane .Le volume molaire gazeux vaut Vm=22,4L/mol.
1) Écris l'équation-bilan de la réaction.
2) Calcule le volume de dichlore nécessaire pour transformer 1m³ d'acéthylène.
Mes réponses.
1) et 2) voir schéma ci-dessous.
Oui, c'est bien C2H2Cl4
Alors utilise cette formule brute pour écrire correctement l'équation de la réaction de l'acétylène sur le dichlore.
2) VC2H2/1= VCl2/2=VC2H2Cl4/1
V(C2H2) = V(Cl2) / 2
L'énoncé donne V(C2H2) ce qui permet de calculer V(Cl2) sans avoir à utiliser le volume molaire des gaz
Le plus simple est de lire mon post du 26-01-20 à 12:00 dans lequel j'explique justement .... comment faire .
22,4 L/mol n'est pas le volume de C2H2 : C'est le volume molaire des gaz qui est une donnée superflue
et donc inutile ici.
Le vrai volume de C2H2 est écrit "noir sur blanc" dans l'énoncé.
Le trouveras tu ?
Othniel2, peux-tu m'expliquer comment tu arrives à gérer un exercice de math et un de chimie simultanément ? ....alors que tu ne sais faire ni l'un ni l'autre ...
Lire et utiliser ma réponse du 26-01-20 à 12:00
A quoi bon demander une aide si tu n'utilises pas celle qu'on te donne ?
V(C2H2) = V(Cl2) / 2
L'énoncé donne V(C2H2) ce qui permet de calculer V(Cl2) sans avoir à utiliser le volume molaire des gaz mais comment ? Puisqu'on ne connait pas VC2H2 .
Relis donc ce que tu viens d'écrire :
L'énoncé donne V(C2H2)
Sais tu lire un énoncé ?
Cette question t'a déjà été posée :
26-01-20 à 17:28
et tu y as déjà répondu !
26-01-20 à 17:37