Inscription / Connexion Nouveau Sujet
Quotient de réaction Q et constante d'équilibre K
Bonjour, j'ai pas compris un exercice fait en cours.
Ecrire Q et K pour la réaction AH(soluté) + H2O(l) = A-(soluté) + H30+(soluté)
Bonjour
Pour une réaction quelconque d'équation :  A +
A +  B =
B = 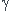 C +
C +  D
D
où  ,
,  ,
, 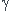 ,
,  désignent les coefficients stchiométriques, le quotient de réaction a pour expression générale :
désignent les coefficients stchiométriques, le quotient de réaction a pour expression générale :
où a(A), a(B),... désignent les activités des espèces chimiques A, B, C et D.
Pour un solvant (ici l'eau) l'activité vaut 1.
Pour une espèce dissoute, la solution étant diluée, l'activité est numériquement égale à la concentration mesurée en mol/L. Dans l'exemple que tu cites, le quotient de réaction vaut donc :
La constante d'équilibre est la valeur que prend le quotient de réaction Q dans le cas particulier où l'équilibre chimique est atteint :
Les constantes d'équilibre ont été mesurées de façon précise et sont en général fournies par les "tables thermodynamiques".
Pour les réactions acide - base dans l'eau, les réactions sont très rapides : les équilibres sont atteints de façon quasi instantanée. En pratique, on se limite presque toujours à l'étude des équilibres : pour chaque réaction, le quotient de réaction est égal à la constante d'équilibre.
Mais tout cela doit être dans ton cours...
Et ben non, c'est un exemple qu'il y a dans le cours, pas la formule, donc j'ai eu du mal à comprendre.
Sinon, rassures moi, tu ne t'es pas trompé. Si je regarde l'exemple de mon cours et ce que tu fais, dans la formule, activité de a et activité de b serait plutôt en bas et activité de c et activité de d en haut non ?
Tu as raison : j'ai effectivement permuté numérateur et dénominateur dans l'expression générale. Toutes mes excuses pour cette faute d'inattention. Pas de problème en revanche pour les expressions concernant la réaction d'un acide sur l'eau...


