Inscription / Connexion Nouveau Sujet
Questions en thermodynamique
Bonjour,
J'ai révisé la thermodynamique et j'ai trouvé des zones d'obscurité que j'ai traversé au cours de l'année sans m'en rendre compte. J'ai plusieurs questions sur des détails de cette branche de la physique. J'espère que vous pourrez m'aider dans la limite du possible.
Le premier principe de la thermodynamique énonce que pour tout système thermodynamique, on peut définir, à une constante près, une fonction , appelée énergie interne, et qui est une fonction d'état, extensive et qui se conserve dans un système isolé et tel que ( si le système est fermé ) :
J'aimerais vous demander si la propriété de se convervation dans un système isolé n'est pas une conséquence, car pour un système isolé ( donc en particulier il est fermé ) :
Et est-ce qu'on ne pourrait pas ajouter que est additive ? Ou c'est suffisant de dire qu'elle est extensive ? Car je ne pense pas que toutes les grandeurs extensives sont additives par exemple, en prenant un volume V1 d'eau auquel on rajoute un volume V2 d'alcool. Alors au final on n'a pas la somme des volumes.
Quelle est l'interprétation physique de l'enthalpie ? Je vois qu'on peut l'écrire comme c'est donc la chaleur échangée lors d'une transformation isobare et pendant laquelle le système reçoit du travail de la part des forces extérieures ? ( Comme ca on a
et donc
avec
)
Mais est-ce réellement cela ? Je ne vois pas trop son intérêt aussi. Elle facilite les calculs lors d'une transformation isobare, mais on peut toujours s'en passer je pense.
La capacité thermique est une grandeur qui mesure l'énergie qu'il faut fournir à un corps pour augmenter sa température de 1K car en écrivant : alors
, donc pour
on a
, en considérant que la capacité thermique ne varie pas sur une échelle de variation de la température de 1K. Mais, en thermodynamique statistique on voit que la capacité thermique est intimement liée aux fluctuations d'énergie des particules. On remarque que plus les fluctuations sont grandes, plus la capacité est grande. Et lorsque la température est grande, l'agitation thermique est grande, et donc le transfert de chaleur se fait plus aisément n'est-ce pas ? ( je parle de conduction thermique ) Est-ce qu'on pourrait dire que la capacité thermique mesure aussi la "capacité" d'un corps à échanger de l'énergie par conduction ?
Est-ce que l'existence de la fonction entropie n'est énoncée par le deuxième principe de la thermodynamique que pour les systèmes fermés ? Ou est-ce qu'elle existe pour tous les systèmes, mais seulement pour un système fermé qu'on a la relation :
Il y'a un théorème qui s'appelle théorème de Clausius qui dit que l'énergie thermique ne peut passer spontanément d'un corps froid à un corps chaud.
Je pense que spontanément veut dire système isolé. Je prends donc un système isolé constitué de deux corps et
de températures respectivement
. Système isolé macroscopiquement au repos donc :
donc :
mais il n'y a pas de travail de forces de pression ou autre, et l'échange avec l'extérieur est nul ( système isolé ) donc il n'y a que l'échange entre les deux corps :
. Là je dois sûrement utiliser l'entropie pour déduire plus de conditions sur
et
mais on a pas d'informations sur
.
Est-ce que par hasard, ce théorème serait une "formulation macroscopique" de la loi de Fourier : ( le transfert thermique se fait des régions chaudes vers les régions froides ).
Auriez-vous des exemples dans lesquels le thermostat échange de manière réversible de l'énergie thermique ? Je sais que le caractère réversible est juste une hypothèse, mais y'a t il des cas concrets dans lesquels on peut considérer que le thermostat échange de manière reversible de l'énergie thermique avec un corps ?
Le troisième principe de la thermodynamique permet de déterminer la constante à laquelle est définie l'entropie. Mais cela demande un cristal parfait. Est-ce qu'un cristal parfait est l'hypothèse de considérer les motifs du corps comme étant parfaitement périodique donc l'espace ( du coup comme définit dans la cristallographie ).
Est-ce que si le cycle dans le diagramme isentropique est dans le sens horaire alors le cycle est récepteur, et si dans le sens trigonométrique alors il est moteur ? ( l'inverse du diagramme de Clapeyron ).
Est-ce qu'une machine thermique monotherme a toujours son efficacité thermique égale à 1 ? Cela me semble bizarre que toutes les machines thermiques monothermes aient le même rendement mais en même temps c'est cohérent avec la théorie car : avec
donc
.
Pourquoi l'enthalpie de changement d'état augmente de solide vers liquide puis vers gaz ? C'est similaire à l'entropie, mais pour l'entropie on dit que le "désordre" augmente. Est-ce qu'il y'a une justification théorique ou qualitative de cette augmentation d'enthalpie de changement d'état ?
Pourquoi la pente de la courbe qui sépare deux phases condensées est très grande s'il vous plaît ? Comparée à la pente de la courbe qui sépare solide/gaz et liquide/gaz.
De même, on justifie que la pente de l'équilibre solide-liquide pour l'eau est négative car la masse volumique de l'eau solide est plus petite que la masse volumique de l'eau liquide. Mais, je ne vois pas en quoi cette masse volumique influence la pente de changement d'état. Est-ce que vous pourrez m'expliquer la relation s'il vous plaît ?
Est-ce que le passage d'un état solide par exemple à l'état de fluide supercritique est considéré comme changement d'état ? Car on dit par exemple que la transition liquide-vapeur n'est plus observable. Donc c'est comme si ce n'est pas réellement un état.
Est-ce que vous pouvez me donner des exemples de changement d'état de solide vers gaz ( sublimation ) et de gaz vers solide ( condensation ). Car j'arrive difficilement à imaginer comment on passe d'un solide à un gaz ( ou l'inverse ) sans passer par l'état liquide. Déjà on s'intéresse usuellement qu'aux changements d'état liquide/vapeur vu qu'on donne un nom précis à la pression de cet équilibre : pression de vapeur saturante. Mais qu'on parle pas des pressions des autres équilibres.
J'aimerai poser une question sur les isothermes d'Andrews dans le diagramme de Clapeyron. Premièrement, sur le tracé. Je pense qu'on garde T constante ( grâce à un fluide par exemple qui circulera dans l'enceinte où on fait le changement d'état ) et on varie la pression P. Mais comment on calcule le volume massique à chaque instant ?
Deuxième question, à quoi servent-ils ? Est-ce que c'est juste pour avoir les volumes massiques ?
Il y'a le théorème des moments qui dit que : et
. Mais la donnée d'après la courbe ne donne que
et il faudra calculer
et
d'une façon ou d'une autre pour retrouver les titres massiques. Donc on a pas vraiment facilité la tâche non ?
Notons l'enthalpie massique de changement d'état d'une phase à une phase
:
. Alors on a
. Est-ce que pour faire le changement d'état inverse alors il faut une énergie :
? Théoriquement c'est ca. Mais je trouve comme même un peu bizarre. Car il est plus facile par exemple d'obtenir de la vapeur d'eau à partir de l'eau liquide que l'inverse.
J'ai posé une tonne de questions et je n'attends pas à avoir des réponses à toutes les questions d'un seul coup. J'espère que vous pourrez m'aider progressivement à comprendre toutes ces subtilités de la thermodynamique et d'essayer de maîtriser ses engrenages.
Merci d'avance,
bonjour,
ca va occuper le forum tout l'été! 
# premier principe de la thermodynamique:
dE = 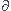 W +
W + 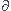 Q
Q
où E désigne l'énergie totale du systeme considéré.
Si le systeme est isolé, dE = 0 (mais pas forcément dU)
Si par ex. E = U + Ec + Ep alors on peut juste conclure que d(U+Ec+Ep) = 0
rien n'empeche le systeme isolé d'évoluer à masse et énergie totale constante.
En thermo classique, il arrive souvent que dE  dU pour le gaz étudé (ex: s'il n'y a pas de mouvement d'ensemble), mais ca reste un cas particulier.
dU pour le gaz étudé (ex: s'il n'y a pas de mouvement d'ensemble), mais ca reste un cas particulier.
# sublimation: un exemple de la vie courante est la naphtaline qui sert d'antimites et se sublime à température ambiante.
condensation: la glace des comètes se transforme directement en gaz lorsqu'elles se rapprochent du soleil, car la pression est bcp trop faible pour que de l'eau liquide se forme.
Bonjour EvDavid, Bonjour Krinn,
Je veux bien gérer quelques questions auxquelles krinn n'a pas eu le temps de répondre ; le message de EvDavid est effectivement long !
Quelle est l'interprétation physique de l'enthalpie ?
Le mot enthalpie provient d'un mot grec qui signifie "chaleur". Effectivement, pour un système fermé, la variation d'enthalpie correspond à la chaleur reçue lors d'une évolution isobare ou monobare ; cela est très général puisque cela inclut toutes les transformations se déroulant à l'air libre, sous la pression atmosphérique supposée constante pendant la durée de l'expérience.
Est-ce que si le cycle dans le diagramme isentropique est dans le sens horaire alors le cycle est récepteur
En diagramme (P,v) comme en diagramme (T,s), comme en diagramme (P,h), un cycle décrit dans le sens horaire est moteur. Tu trouveras de nombreux exemples sur le net.
Pourquoi la pente de la courbe qui sépare deux phases condensées est très grande s'il vous plaît ?
Il faut partir de la formule de Clapeyron donnant le coefficient directeur d'une courbe d'équilibre entre deux phase a et b de la courbe Ps=f(T) :
au numérateur : enthalpie massique de changement d'état (autrefois appelée chaleur latente massique) ; au dénominateur : variation de volume massique à la température T d'équilibre.
On voit bien que, si a et b sont deux phases condensées, la variation de volume massique est très faible ; la valeur absolue du coefficient directeur est a priori très grande.
J'aimerai poser une question sur les isothermes d'Andrews dans le diagramme de Clapeyron
Les isothermes d'Andrews sont utiles pour déterminer un certains nombres de données expérimentales. Ils permettent aussi de déterminer les constantes a et b de l'équation d'état des gaz de Van der Waals. Il suffit de remarquer que l'isotherme critique présente à la pression critique un point d'inflexion avec tangente horizontale; Dans les conditions critiques, la dérivée première et la dérivée seconde de P par rapport à v sont nulles...
Mais la donnée d'après la courbe ne donne que v(M) et il faudra calculer
Le diagramme (P,v) prend en compte en général la phase vapeur et la phase liquide. Les abscisses de la courbe de rosée et de la courbe d'ébullition commençante fournissent les volumes massiques
alors il faut une énergie :
Les enthalpies massiques de changement d'état (autrefois chaleurs latentes) correspondent à des variations de fonction d'état : h2-h1=-(h1-h2)...
Cela me semble bizarre que toutes les machines thermiques monothermes aient le même rendement
Cela est vrai uniquement pour une machine réceptrice : le deuxième principe de la thermo permet de démontrer qu'un cycle moteur monotherme ne peut exister. Cela prouve simplement qu'il est possible de transformer intégralement du travail en chaleur alors que la transformation intégrale inverse est impossible.
Une qui a été oubliée :
Est-ce que l'existence de la fonction entropie n'est énoncée par le deuxième principe de la thermodynamique que pour les systèmes fermés ?
Sous cette forme oui. Pour les systèmes ouverts, on contourne la difficulté en raisonnant sur les entropies massiques, ce qui ramène à l'étude de systèmes fermés.
Il y'a un théorème qui s'appelle théorème de Clausius qui dit que l'énergie thermique ne peut passer spontanément d'un corps froid à un corps chaud.
Je pense que spontanément veut dire système isolé.
spontanément veut dire qu'on "laisse faire la nature", donc on n'interpose rien entre les deux corps, ni isolant, ni machine thermique, etc., le système ne subit pas de contrainte particulière
voici une démonstation possible:
Bonjour,
Merci krinn et vanoise pour vos réponses.
Donc il faut vraiment rajouter l'hypothèse que se conserve si le système est isolé.
Pour l'enthalpie, est-ce que ca reste la chaleur reçue pendant une transformation monobare ? Parce qu'on a plus . Peut-être qu'on devrait rajouter l'hypothèse que la transformation est quasi-statique ?
Pour les isothermes d'Andrews, j'avais oublié que la courbe d'ébullition fournissait les et la courbe de rosée fournissait
. J'avais confondu avec
et
qui deviennent égales à 1 respectivement sur ces courbes.
Je pense que votre explication de la pente des équilibres de phases condensées me permet de comprendre pourquoi la pente de l'équilibre solide/liquide de l'eau est négative et non pas positive comme c'est souvent le cas. En reprenant la formule de Clapeyron :
Bon cela dépend du signe de la différence des enthalpies massiques...
L'interprétation qu'on peut transformer intégralement du travail en chaleur et la transformation intégrale inverse est impossible est remarquable ! Pour un radiateur par exemple, on fournit un travail électrique pour le transformer en chaleur n'est-ce pas ?
Merci pour la démonstration du théorème de Clausius. On peut donc dire que c'est une version "macroscopique" de la loi de Fourier non ? Comme avec la loi d'Ohm et la loi d'Ohm locale.
Juste une précision concernant la variation d'enthalpie d'un système fermé. Pour démontrer  H=Q, il suffit de faire l'hypothèse Pext=constante =P 1=P2 où P1 et P 2 sont les pressions initiale et finale du système. Je viens de définir une transformation monobare...
H=Q, il suffit de faire l'hypothèse Pext=constante =P 1=P2 où P1 et P 2 sont les pressions initiale et finale du système. Je viens de définir une transformation monobare...
Supposer en plus la transformation quasi statique conduit à conserver les relations entre pressions que je viens d'écrire en ajoutant la condition P=Pext , ce qui correspond à une transformation isobare... D'où mon message précédent...
Bonsoir,
Je pensais que transformation monobare signifiait que pendant la transformation, même si la pression extérieure variait. Et que transformation isobare c'était :
et qu'elle impliquait la monobare.
Non seulement il rectifie les idées fausse. J'essaye de ne pas dire que ce forum est mon professeur principal afin de ne pas enlever le mérite que je me dois d'offrir à mes professeurs de classe. Donc j'avais carrémment mélanger entre isobare et monobare.
Merci beaucoup pour votre aide.
Sinon, vous en pensez quoi de l'hypothèse d'additivité pour et
? Est-ce qu'extensif veut toujours dire additif ?
Je ne suis pas sûr de ce que tu entends par additif. Une chose est sûre : suppose que tu mélanges un système 1 et un système 2.
Même sans échange d'énergie avec l'extérieur l'entropie du mélange n'est pas dans le cas general la somme des 2 entropies avant mélange puisque le désordre à l'échelle moléculaire a augmenté. Idem pour le volume. Mélange 400ml d'éthanol avec 600ml d'eau. Tu vas obtenir moins d'un litre de liquide.
Très rigoureusement : une fonction d'état extensive est une fonction homogène de degré 1 des différentes quantités de matière. Cela te parle ?
Bonjour,
Je connais les fonctions différentiables homogènes d'ordre : une telle fonction
vérifie :
.
Il y'a un théorème en calcul différentiel (pas au programme juste comme exercice) qui s'appelle théorème d'Euler, sur ces fonctions. Il dit qu'une telle fonction vérifie : .
Je pense qu'ainsi, une fonction d'état extensive, serait une fonction comme le précise la définition ci-dessus avec r=1, et le x c'est la quantité de matière. N'est-ce pas ?
Donc une fonction extensive n'est pas forcément additive. Je comprends que l'entropie ne peut pas s'ajouter. Sinon, pour l'énergie interne est-elle additive s'il vous plaît ?
Merci d'avance,
Je crois que tu as maintenant compris la notion de fonction d'état extensive : si tu multiplie chacune des quantités de matière du système par un même réel positif  , à P et T fixes, chaque fonction d'état extensive est multipliée par
, à P et T fixes, chaque fonction d'état extensive est multipliée par  . Oublie l'adjectif "additif" dans le cas général.
. Oublie l'adjectif "additif" dans le cas général.
Concernant l'énergie interne : s'il est possible de réaliser le mélange de sorte que W+Q=0, l'énergie interne finale du mélange est la somme des deux énergies internes avant le mélange mais cela n'a rien de général.
Je vois merci pour votre explication avec les fonctions homogènes.
C'est bon, je vais oublier cet adjectif.
Je pense que même dans les exercices, je ne me souviens pas avoir sommer deux énergies internes de deux corps différents. Dans les machines thermiques et dans le cas des transformations cycliques, on dit que la variation de l'énergie interne pendant le cycle c'est la somme des variations des énergies internes pendant chaque transformation.
Je vais oublier alors l'adjectif "additif". Car dans le cours de mon professeur il l'énonce comme hypothèse mais dans Wikipédia non.
J'aimerais reposer une question sur la capacité thermique :
La capacité thermique est une grandeur qui mesure l'énergie qu'il faut fournir à un corps pour augmenter sa température de 1K car en écrivant : alors
, donc pour
on a
, en considérant que la capacité thermique ne varie pas sur une échelle de variation de la température de 1K. Mais, en thermodynamique statistique on voit que la capacité thermique est intimement liée aux fluctuations d'énergie des particules. On remarque que plus les fluctuations sont grandes, plus la capacité est grande. Et lorsque la température est grande, l'agitation thermique est grande, et donc le transfert de chaleur se fait plus aisément n'est-ce pas ? ( je parle de conduction thermique ) Est-ce qu'on pourrait dire que la capacité thermique mesure aussi la "capacité" d'un corps à échanger de l'énergie par conduction ?
Merci d'avance,
Ta définition de la capacité thermique manque de précision. Puisque Q= U à V fixe, on définit Cv comme la dérivée partielle de U par rapport à T, calculée à V fixe. Remplacer la dérivée partielle par une dérivée dans le cas limite du gaz parfait.
U à V fixe, on définit Cv comme la dérivée partielle de U par rapport à T, calculée à V fixe. Remplacer la dérivée partielle par une dérivée dans le cas limite du gaz parfait.
Puisque Q= H, je te laisse exprimer Cp.
H, je te laisse exprimer Cp.
Pour les liquides et les solides, l'écart est faible.
Ah oui c'est vrai. En thermodynamique classique la capacité thermique à volume constant est : et la capacité thermique à pression constante :
.
Pour un gaz parfait, et selon la deuxième loi de Joule :
Mais en thermodynamique classique on définit la capacité thermique comme non ?
Merci d'avance,
Bonjour,
Merci pour la démonstration du théorème de Clausius. On peut donc dire que c'est une version "macroscopique" de la loi de Fourier non ? Comme avec la loi d'Ohm et la loi d'Ohm locale.
Pas vraiment.
Tu as d'un côté une loi empirique (dun phénomène particulier qui est la conduction, et connue bien avant que soit énoncée la théorique thermodynamique), et de l'autre un résultat théorique très général et donc d'une portée bien plus grande, a mon avis, pour la physique.
Bonjour,
Merci pour votre réponse. Je pensais que tous les deux expliquait pourquoi la chaleur se transmet des corps chauds vers les corps froids. Mais comme vous l'avez dit, le théorème de Clausius est plus général, car par exemple on peut rien dire si on a deux fluides puisque la loi de Fourier ne marche pas. Mais avec le théorème de Clausius on peut toujours conclure.
Bonsoir,
Je m'excuse pour le double-post mais il me reste une question en thermodynamique du sup. Pouvez-vous m'expliquer pourquoi la pente de l'équilibre solide-liquide de l'eau est négative et non positive comme c'est souvent le cas s'il vous plaît ? La réponse c'est car la masse volumique de l'eau solide est plus grande que la masse volumique de l'eau liquide. J'ai essayé de faire le lien avec la formule de Clapeyron : , le volume massique est le volume divisé par la masse, donc c'est l'inverse de la masse volumique, d'où :
Mais le signe dépendra alors dans quel sens on effectue la transformation.
Merci d'avance,
Mais le signe dépendra alors dans quel sens on effectue la transformation
Pas du tout : j'associe l'indice 2 au liquide et l'indice 1 au solide.
(h2-h1) : enthalpie massique de fusion positive.
Dans le cas de l'eau, le volume massique de la glace est supérieur à celui du liquide :
v2-v1<0 : cela conduit à une pente négative de la courbe d'équilibre P=f(T).
Imagine que tu permutes la signification des indices : 1 pour le liquide, 2 pour le solide : cela inverse le signe de l'enthalpie massique de changement d'état (h2-h1) mais cela inverse aussi le signe de v2-v1.
Où est le problème ?


