Inscription / Connexion Nouveau Sujet
Question sur les orbitales moléculaires
Bonjour,
J'ai des questions sur les orbitales moléculaires. J'ai lu ça dans un cours de chimie mais ça utilise de la mécanique quantique. C'est la méthode LCAO qui dit que les orbitales moléculaires sont issues de combinaisons linéaires d'orbitales atomiques.
Ce que je ne comprends pas, c'est pourquoi parfois les orbitales 2p peuvent conduire à des liaisons, que de type ou que de type
et parfois non. Pour clarifier ma question, j'ai vu dans l'établissement du diagramme énergétique de
que les orbitales 2pz de O donnent des liaisons
mais 2py et 2px donnent des liaisons
.
Ce que je sais c'est que normalement on peut avoir du et du
à la fois (ça dépend du nombre d'électrons...). C'est ce "peut" qui me crée problème en fait, car dans le corrigé ils n'ont pas parlé de ça du tout. C'est pour cela que j'aimerais savoir si c'est juste impossible ou c'est un oubli de la part du correcteur.
J'espère que vous pourrez m'aider à connaître la réponse.
Merci d'avance.
Bonjour
Tu connais sûrement la complexité de l'étude rigoureuse de la structure de l'atome H à un seul électron. Alors imagine la complexité de l'étude d'une structure moléculaire où il faudrait tenir compte des interactions de chaque électron avec deux noyaux et tous les autres électrons. Il faut donc procéder par approximations ; la validité des approximations se juge à l'accord plus ou moins grand avec les faits expérimentaux.
Pour répondre à tes questions : dans tous les cas, le recouvrement de deux O.A. ayant chacune l'axe de liaison comme axe de symétrie conduit à une liaison covalence  ; le recouvrement de deux O.A. ayant des axes de symétrie parallèles entre eux et perpendiculaires à l'axe de symétrie conduit à une liaison
; le recouvrement de deux O.A. ayant des axes de symétrie parallèles entre eux et perpendiculaires à l'axe de symétrie conduit à une liaison  .
.
Une fois obtenu le diagramme des orbitales moléculaires, il faut y placer les électrons des deux atomes en respectant les règles habituelles valide pour les orbitales atomiques : principe de stabilité, principe d'exclusion de Pauli, règle de Hund. Le résultat sur le nombre et la nature des liaisons dépend donc effectivement du nombre d'électrons à placer...
Ci-joint : document d'illustration concernant deux cas simples : O2 et N2 :
![]()
Bonjour,
Merci pour votre réponse et pour le document que vous m'avez envoyé. J'ai relu le cours sur la création des liaisons moléculaires et j'ai essayé de faire quelques petits exercices afin de m'entraîner sur ça mais j'ai des questions dont je connais la réponse mais je ne sais pas physiquement pourquoi.
Les questions qui me taraudent le plus, c'est pourquoi, lorsqu'il y a une interaction sp, alors l'énergie de la liaison liante 2p est inférieure à celle de 2s
est inférieure à celle de 2s . Et plus généralement comment on connaît ces énergies pour pouvoir les situer entre elles. Est-ce que c'est un calcul à partir des fonctions d'onde ? Cela me semble assez difficile car j'ai trouvé des valeurs d'énergies de liaison pour le CO.
. Et plus généralement comment on connaît ces énergies pour pouvoir les situer entre elles. Est-ce que c'est un calcul à partir des fonctions d'onde ? Cela me semble assez difficile car j'ai trouvé des valeurs d'énergies de liaison pour le CO.
La deuxième question concerne l'utilisation des orbitales hybrides ou non. Je sais que pour le méthane il faut l'utiliser... mais pourquoi ? Pourquoi la LCAO marche pour le CO et par pour le méthane. Je trouve même que la LCAO ne marche pas pour le CO parce que quand j'essaie d'établir le diagramme énergétique du CO à partir de cette méthode, je trouve qu'il y a une liaison sigma liante qui résulte de l'interaction entre 2s du C et 2pz (en supposant que c'est l'axe atomique) de O et une liaison sigma anti-liante. Et il va rester des électrons dans la 2p du C et 2p. Puisque la 2pz du O a déjà participé à une liaison, il ne va rester que la 2py et 2px et on aura des liaison  .
.
Mais selon les énergies d'orbitales moléculaires que j'ai à ma disposition, il y a encore des liaisons  , ce que je ne comprends pas.
, ce que je ne comprends pas.
Les énergies d'orbitales molécules pour le CO sont : -538 (orbitale 1) ; -288 (orbitale 2) ; -40,5 (3  ) ; -19,9 ( 4
) ; -19,9 ( 4  ) ; -15,8 (1
) ; -15,8 (1  ) ; -13,5 (5
) ; -13,5 (5  ) ; 7,1 (2
) ; 7,1 (2  ) ; 25,3 (6
) ; 25,3 (6  )
)
Les deux premières énergies sont respectivement de la 1s de O et 1s du C. Puis c'est la  qui résulte de la 2s du C et 2p de O, et après c'est la
qui résulte de la 2s du C et 2p de O, et après c'est la  *. Normalement à ce stade il ne reste que 2 électrons pour O dans la couche 2p et de même pour C. Sachant que pour avoir une liaison entre une couche 2s et une couche 2p il faut que la 2p soit sur l'axe atomique, alors les 2 électrons pour O restants sont répartis les 2p restants. Donc normalement on ne devrait avoir que des liaisons
*. Normalement à ce stade il ne reste que 2 électrons pour O dans la couche 2p et de même pour C. Sachant que pour avoir une liaison entre une couche 2s et une couche 2p il faut que la 2p soit sur l'axe atomique, alors les 2 électrons pour O restants sont répartis les 2p restants. Donc normalement on ne devrait avoir que des liaisons  qui restent.
qui restent.
J'espère que vous pourrez m'aider encore une fois à comprendre ce qu'il se passe. J'y ai réfléchis maintes fois sans résultat. Je refais le même raisonnement à chaque fois donc problablement je me trompe sur quelque chose.
Merci d'avance.
Merci beaucoup pour votre réponse. L'aspect mathématique est assez difficile mais éclairant aussi. Mais sinon pour le lien avec les illustrations, je ne comprends pas l'exemple du CO. J'ai toujours le même problème. L'énergie de la couche 2s du carbone est -16.6 eV et celle de l'oxygène est de -28.5. La différence d'énergie est de l'ordre de 12eV donc on n'aura pas de liaison entre ces deux couches. Par contre l'énergie de la couche 2p de l'oxygène est -13.6 eV, ce qui permet d'avoir une liaison entre la 2s du carbone et la 2p de l'oxygène. Ce qui donne une  liante et
liante et  anti-liante. Et il peut y avoir des liaisons entre "les" 2p "restantes" de l'oxyègene et celles du carbone, mais elles ne mettent en jeu que 4 électrons au total, alors que dans le document c'est 6 électrons. Et je pense qu'il ne devrait y avoir que des liaisons
anti-liante. Et il peut y avoir des liaisons entre "les" 2p "restantes" de l'oxyègene et celles du carbone, mais elles ne mettent en jeu que 4 électrons au total, alors que dans le document c'est 6 électrons. Et je pense qu'il ne devrait y avoir que des liaisons  puisque la 2pz de l'oxygène a déjà joué son rôle avec la 2s du carbone.
puisque la 2pz de l'oxygène a déjà joué son rôle avec la 2s du carbone.
Le document fournit cette explication : "Nous supposerons que les électronégativités de C et O sont suffisamment proches pour leurs niveaux respectifs s et p puissent interagir entre eux. Nous supposerons de plus que des interactions sp sont possibles." Mais les deux phrases ne veulent-elle pas dire la même chose ?
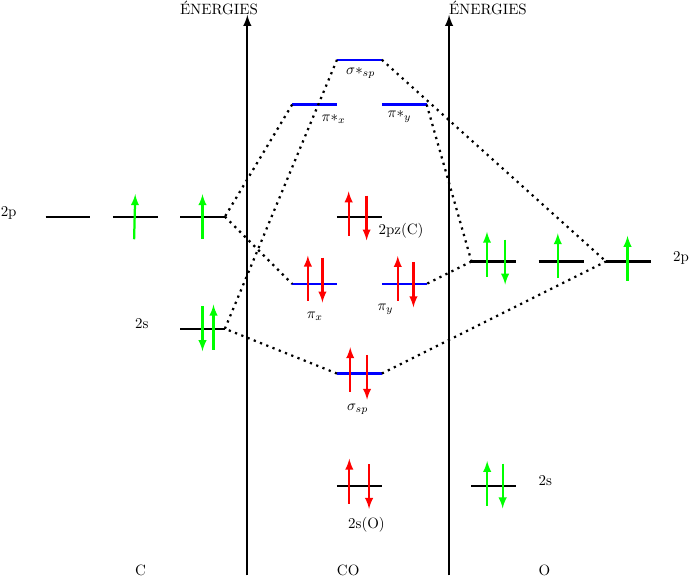
Je veux bien détailler un peu le cas de la molécule CO.
1° : on ne prends en compte que les électrons desz couches de valence respectives :
2s2 2p2 pour C ; 2s2 2p4 pour 0.
2° : les électrons 2s de O sont d'énergie nettement plus faibles que les électrons 2s de C : pas de combinaison possible des orbitales atomiques en orbitales moléculaires : pas de recouvrement, pas de liaison. Il s'agit d'un doublet d'électrons de valence qualifié de non liant.
3° : combinaison linéaire de l'OA 2s de C avec l'OA 2pz de O ; cela conduit à une OM  sp liante occupée par 2 électrons et à une OM
sp liante occupée par 2 électrons et à une OM  *sp non liante non occupée.
*sp non liante non occupée.
4° : combinaison linéaire de l'OA 2px de C avec l'OA 2px de O et combinaison linéaire de l'OA 2py de C avec l'OA 2py de O : cela crée deux OM liantes  x et
x et  y chacune occupées par deux électrons de liaison ainsi que deux orbitales antiliantes
y chacune occupées par deux électrons de liaison ainsi que deux orbitales antiliantes  *x et
*x et  *y non occupées.
*y non occupées.
5° reste l'OA 2pz de C qui ne peut se combiner avec aucune OA de O puisque l'OA 2pz de O est déjà combinée à l'OA 2s de C. Elle conserve donc son énergie, ce qui la situe entre les OM liantes  mais nettement en dessous des OM antiliantes. Conséquence : elle est occupée par deux électrons qui constitue un doublet non liant.
mais nettement en dessous des OM antiliantes. Conséquence : elle est occupée par deux électrons qui constitue un doublet non liant.
6° : au final : les atomes C et O sont liés par 3 liaisons covalentes : une de type  et deux de type
et deux de type  , chaque atome possédant un doublet de valence non liant. Ce modèle est conforme à la formule de Lewis classique :
, chaque atome possédant un doublet de valence non liant. Ce modèle est conforme à la formule de Lewis classique :
***Taille de l'image réduite***
Merci pour ces détails et cette explication. J'ai toutefois deux doutes.
Le premier concerne le point 3°, sachant que pour C il a deux électrons dans sa 2s, et pour O il a 4 électrons dans sa 2p, pourquoi la  *sp est non occupée ? Je veux dire, il se peut bien qu'elle soit remplie par l'électron restant de la 2s de C et l'électron qui est apparié quelque part dans la 2p non ?
*sp est non occupée ? Je veux dire, il se peut bien qu'elle soit remplie par l'électron restant de la 2s de C et l'électron qui est apparié quelque part dans la 2p non ?
Et sinon même si ça n'arrive pas, je comprends pas pourquoi dans le point 5° il reste un électron dans l'orbitale 2pz sachant que les deux électrons dans 2p qu'avait le carbone ont été utilisés dans les liaisons  .
.
Merci d'avance.
Je ne suis pas sûr que tu prennes bien en compte mon message du 19-06-20 à 11:28. La construction du diagramme des orbitales moléculaires se fait à partir du diagramme des orbitales atomiques des deux atomes concernés sans se préoccuper des électrons occupant ou non ces orbitales atomiques. On place ensuite les électrons de valence en respectant les règles habituelles sans se préoccuper de la provenance de ces électrons.
Soit la combinaison de deux OA d'énergies E1 et E2 avec E2>E1, sans que la différence ne soit trop élevée pour interdire cette combinasion. On obtient une OM liante d'énergie E1- E et une OM antiliante d'énergie E2+
E et une OM antiliante d'énergie E2+ E* avec
E* avec  E*>
E*> E, l'écart étant d'autant plus important que (E2-E1) grand. Conséquence ici ; l'OM
E, l'écart étant d'autant plus important que (E2-E1) grand. Conséquence ici ; l'OM  *sp est la moins stable de toutes les OM du diagramme et n'est donc pas occupée.
*sp est la moins stable de toutes les OM du diagramme et n'est donc pas occupée.
Illustration de mon message du 20-06-20 à 16:14. Attention : les niveaux d'énergies ne sont pas placées "à l'échelle" mais l'ordre des niveaux est correct.