Inscription / Connexion Nouveau Sujet
Question pertinence constante d'équilibre
Bonjour, j'ai un tp ou on fait un suivi ph métrique de l'acide oxalique et de l'acide titrique par de la soude.
On nous demande de donner les valeurs des constantes d'équilibre des réactions en utilisant les pka des couples donnés en annexe.
Je fais mes calcul avec les pka des couples H2O/OH- et et H2C2O4/HC2O4- par exemple pour la première acidité de l'acide carboxylique.
Je vous épargne les calculs mais je trouve des constantes d'équilibres très faible : entre 10^-10 et 10^-13 pour les résultats.
Est ce pertinent? j'ai peur de mettre un truc faux dans mon compte rendu...
Merci ^^
Je fais mes calcul avec les pka des couples H2O/OH- et et H2C2O4/HC2O4- par exemple pour la première acidité de l'acide carboxylique.
*de l'acide oxalique pardon
Écris l'expression de la constante d'équilibre K puis multiplie numérateur et dénominateur de l'expression par la concentration en ions oxonium. Cela va te donner K en fonction de Ka et Ke le produit ionique de l'eau. Tu vas obtenir une valeur nettement supérieure à un.
Ok donc je prends le Ke en compte dans mon calcul?
Et puis après on me demande la constante d'équilibre de l'acétate de sodium avec l'acide chlorhydrique. Est ce que j'utilise le Ke aussi?
La méthode est immédiate :
Pour le premier cas :
L'acide oxalique est un diacide ; il faut aussi prendre en compte la seconde réaction de titrage...
Ok donc pour la constante d'équilibre de l'acétate de sodium je trouve donc une valeur plus faible que pour les diacides étudiés.
Pour les diacides j'ai bien calculé pour les deux titrages, est ce que je peux exprimer les deux acidités en une seule réaction avec une seule constante d'équilibre? 
est ce que je peux exprimer les deux acidités en une seule réaction avec une seule constante d'équilibre?
S'il s'agit bien d'étudier le dosage du diacide par la soude, je pense qu'il s'agit d'une très mauvaise idée. Deux cas sont envisageables :
1° Le rapport des deux constantes K1/K2 correspondant aux deux dosages est très grand devant 1 (au moins 104) : les deux dosages peuvent être considérés comme successifs et indépendants. Les équilibres ont beau êtres simultanés, le taux de la seconde réaction reste proche de zéro tant que le taux de la première réaction reste inférieur à 99% ; cela se traduit par deux sauts de pH lors du dosages. Une équation globale ne rendrait évidemment pas compte de ce caractère successif des deux réactions.
2° Le rapport des deux constante K1/K2 est inférieur à 104 environ. Les deux réactions se produisent alors simultanément ; un seul saut de pH est observé. Cependant, se ramener à un équilibre global priverait de tout renseignement sur la concentration en espèce intermédiaire AH-.
As-tu un dosage pH-métrique précis à étudier ou s'agit-il pour l'instant de généralités sur les méthodes possibles ?
Non j'ai un suivi ph métrique précis que j'ai tracé. Enfin sinon je crois que je vais garder ce que tu m'a conseillé de mettre.
Par contre j'ai une seconde question: on a à faire un troisième suivi ph métrique/conductimétrique ou on a un mélange de bases (base forte et base faible l'acétate de sodium) avec un titrage par acide chlorhydrique.
On nous demande d'expliquer l'ordre des réactions qui interviennent au cours du dosage hors je n'en ai pas la moindre idée, pourrais tu m'aiguiller?
J'ai eu l'occasion il y a quelque temps de rédiger une fiche assez complète sur ce genre de sujet. L'exemple de mon document ne correspond pas exactement à ton problème mais la méthode à utiliser est la même. Les généralités des premiers paragraphes devraient t'aider...
Je te laisse regarder tout cela. Pose ensuite des questions complémentaires si tu le juges utile.
![]()
Ok donc après une lecture assez rapide j'en déduit qu'il faut que je détermine la réaction prépondérante. Je fais cela en calculant les ka?
Merci pour ton aide!
Commencer par classer les couples acide /base en fonction des pKa en repérant les espèces introduites en quantités non négligeables permet de trouver la réaction prépondérante. La détermination de la constante d'équilibre confirme ensuite le résultat. C'est ce que j'explique dans la première partie du document...
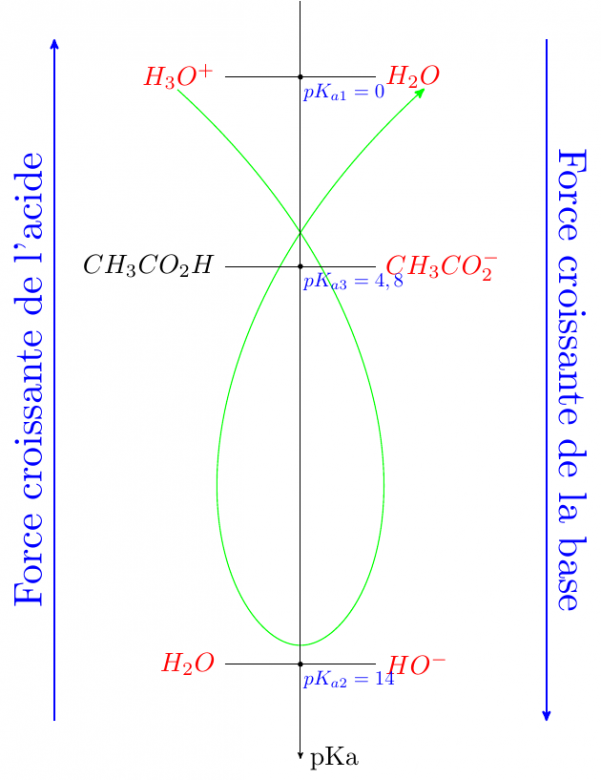
Voici le diagramme des pKa adapté à ton problème : dosage par un acide fort d'un mélange {soude - éthanoate de sodium} par un acide fort. Les espèces écrites en rouge correspondent aux espèces introduites en quantités non négligeables : ce sont les seules qui peuvent intervenir comme réactifs dans la première réaction prépondérante. Cette réaction prépondérante se fait entre l'acide le plus fort et la base la plus forte. Je te laisse calculer la constante d'équilibre mais, au premier coup d'il : cette réaction se fait en respectant la règle du gamma, donc K>1 et l'écart de pKa est grand : K>>1.
On peut aussi envisager la réaction des ions éthanoate sur l'acide fort... Tu devrais t'en sortir avec les explications fournis dans mon document.