Inscription / Connexion Nouveau Sujet
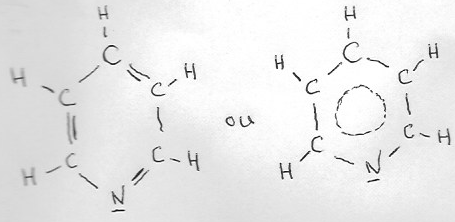
Pyridine
Bonjour,
Dernière fois que je vous embete avec ces petites questions parce que j'ai mon examen demain. Et j'aimerai avoir une confirmation car mon prof a dit que cette molécule y sera.
Dans la pyridine, l'atome d'azote est dans une orbitale SP2 et son doublet non liant aussi?
Mercii bcq 
Bonjour
L'atome N possède 5 électrons de valence .
On obtient une hybridation sp2 par combinaison linéaire de l'orbitale 2s avec les orbitales 2px et 2py.
Ces trois orbitales 2sp2 sont occupées par quatre électrons , deux assurent les deux liaisons avec les deux atomes C voisins, les deux autres correspondent au doublet non liant. Cette hybridation sp2 est compatible avec une structure plane et un angle de liaison de 120°.
avec les deux atomes C voisins, les deux autres correspondent au doublet non liant. Cette hybridation sp2 est compatible avec une structure plane et un angle de liaison de 120°.
Je ne développe pas le cas des atomes de carbone : situation identique au cas de la molécule de benzène.
Remarque : pour plus de précision, la formule de Lewis devrait être celle-ci :

 délocalisé est en 2pz.
délocalisé est en 2pz.
