Inscription / Connexion Nouveau Sujet
Problème exercice thermodynamique
Bonjour,
Voilà déjà quelques jours que je travaille sur un exercice, mais je suis totalement bloquée car je n'arrive pas à trouver un diagramme de Clapeyron qui soit correct et encore moins la température T1, merci de l'aide que vous pourrez m'apporter 🙂
voici l'énoncé en photo, et le diagramme que j'ai essayé de faire, je me doute bien que la solution est très simple mais je fais un énorme blocage je ne comprend absolument pas comment tracer le cycle 😫
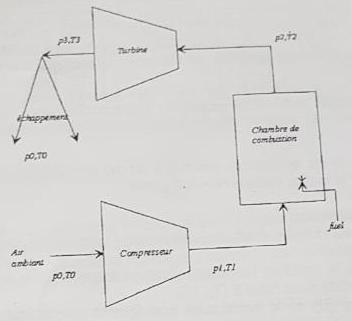
** image supprimée **
Bonsoir
Comme demandé, je raisonne sur les grandeurs massiques représentées par des lettres minuscules. L'allure générale de ton diagramme est correcte. Si la compression et la détente dans la turbine étaient réversibles, elles vérifieraient . Ici les évolutions sont irréversibles mais l'allure des courbes est la même. Je t'aide pour la compression. Si elle était adiabatique réversible, le gaz étant assimilé à un gaz parfait, la température de sortie serait :
Le travail technique massique de compression serait :
(seconde loi de Joule pour un gaz parfait)
A cause de l'irréversibilité, le travail technique massique w' nécessaire à l'entraînement du compression est supérieur au travail technique massique réversible. Il vaut :
Le rendement isentropique de la compression est défini par :
Tu as tous les éléments pour déterminer T1... La méthode est analogue pour la détente mais attention : à cause de l'irréversibilité, la turbine fournit moins de travail massique que si la détente était réversible. Le rendement isentropique de la détente est défini par :
Les « valeurs absolues » ne sont pas indispensables. Je les ai placées pour rappeler que pour une détente, le travail technique massique est négatif.
Je te laisse continuer...
Bonjour,
Je ne suis pas sûre d'avoir compris la différence entre T1 et T1r, ou encore W et Wr
Car dans tout les exercice que j'ai fait avant je n'ai utilisé que T et W.
De plus pour T1 jobtien la formule qui est en photo ci jointe. Et non pas celle que vous m'avez indiquer 😔
J'ai encadré quelques résultats qui me paraissent bizarres.
Et pour finir je ne comprend absolument pas quelle formule il faut utiliser pour calculer le Qd recu par l'atmosphère ...
Merci encore pour votre aide 😄
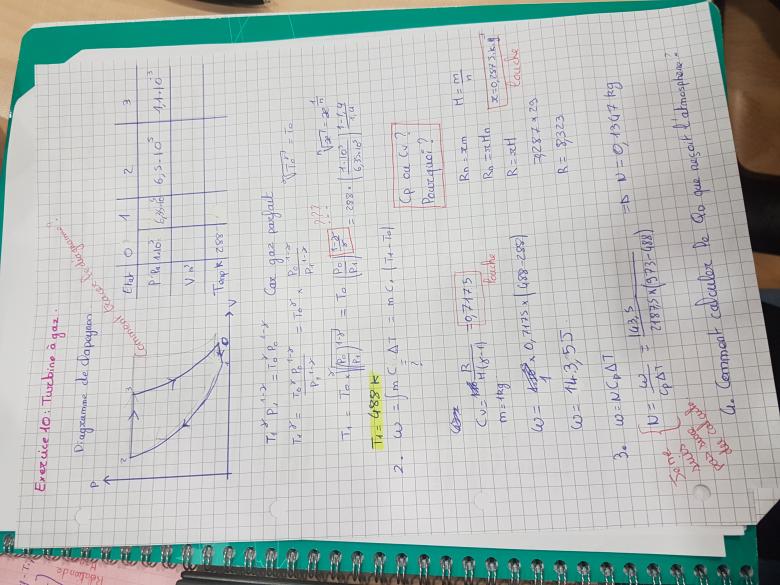
Je ne suis pas sûre d'avoir compris la différence entre T1 et T1r, ou encore W et Wr
Effectivement : tu ne tiens pas compte du rendement isentropique du compresseur :
 i=0,87
i=0,87
La détente est adiabatique : le premier principe valide pour les systèmes ouverts conduit à :
w' = h1 -h0
Tu dois connaître les deux lois de Joule sur les gaz parfaits :
1ère loi :
 u=cv.
u=cv. T
T
2ième loi :
 h=cp.
h=cp. T
T
La détente est aussi irréversible : en mettant un indice r pour l'évolution fictive réversible, le compresseur consomme plus d'énergie que si la compression était réversible : w'>w'r et justement le rendement isentropie est le quotient des deux travaux massiques :
 i=w'r/w'.
i=w'r/w'.
Puisque ce rendement isentropique fournit une relation entre l'évolution réelle irréversible et l'évolution fictive réversible qui correspondrait au même taux de compression, il faut donc commencer par étudier la compression fictive réversible. C'est ce que j'ai fait en commençant par calculer la température de sortie fictive T1r correspondant à la compression fictive réversible. Une fois compris ce que je viens d'écrire, tu pourras reprendre mon premier message.
Bonjour, j'ai enfin terminé cet exercice en m'arrachant de bonne poignée de cheveux ^^
DSL pour les photo je n'avait pas compris qu'elles n'étaient pas au "normes".
Le seul problème qu'il me reste est la dernière question, je dois proposer une amélioration de l'installation qui fais appel à un échangeur de chaleur placé judicieusement et je dois montrer qu'il y à réduction des pertes totales.
Et la c'est la catastrophe, je ne comprend pas ce qu'il faut proposer comme amélioration, et pour montrer que cela réduis les pertes, dois-je recommencer tout les calculs?
Merci ^^
Bonjour
Tu as sûrement remarqué que les gaz sortant de la turbine à une température T3 relativement élevée sont directement rejetés dans l'atmosphère. Outre l'aspect écologique (cela contribue au réchauffement climatique) cela a pour conséquence de conduire à un rendement relativement faible : une partie importante de l'énergie thermique fournie par la combustion du méthane est rejetée dans l'air.
Puisque T3 > T1, il est possible d'installer entre le compresseur et la chambre de combustion un échangeur thermique dans lequel les gaz sortant de la turbine céderaient de la chaleur à l'air sortant du compresseur. L'air entrerait ainsi dans la chambre de combustion à une température supérieure à T1 et les gaz de combustion seraient rejetés dans l'air à une température inférieure à T3. La quantité de combustible à fournir pour atteindre la température T2 serait ainsi plus faible sans que la puissance de la turbine ne soit modifiée. Le rendement de l'installation serait ainsi plus élevé.
Bonjour
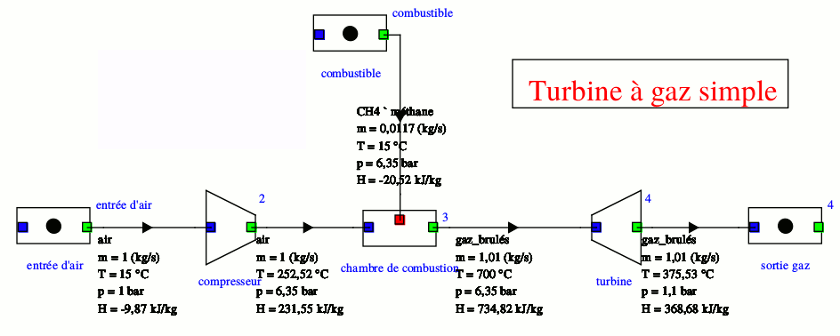
Pour illustrer mon propos précédent, voici deux simulations informatiques.
La première concerne la turbine simple que tu viens d'étudier. Le logiciel choisit comme état d'enthalpie nulle, l'air à 25°C sous 1bar. Mais peu importe : seules les variations d'enthalpies massiques ont de l'intérêt. Le logiciel tient compte de la présence après combustion du méthane, de vapeur d'eau et de dioxyde de carbone et n'assimile pas les gaz à des gaz parfaits. Les températures sont ainsi très légèrement différentes de celles que tu as obtenues. Concernant la quantité massique utile : il s'agit de l'énergie massique que peut fournir la turbine à l'extérieur ; c'est donc la différence entre l'énergie massique qu'elle fournie et le travail massique de compression :
wutile=(734,92-368,68)-(231,55+9,87)=124,72kJ/kg
la quantité coûteuse est la quantité de chaleur massique fournie par la combustion du méthane :
qcoûteuse =734,82-231,55=503,27kJ/kg
Le rendement thermodynamique de l'installation est donc :
La seconde concerne ma même installation avec ajout d'un échangeur thermique entre le compresseur et la chambre de combustion. Ainsi, les gaz brûlés sont injectés dans l'air atmosphérique à température plus faible : 260°C au lieu de 375°C et surtout : l'air pénètre dans la chambre de combustion à température nettement plus élevée : 350°C au lieu de 252°C, la quantité de méthane à brûler pour atteindre les 700°C en sortie de chambre de combustion est nettement moindre. La quantité de chaleur massique coûteuse est maintenant :
qcoûteuse=731,31-333,76=397,55kJ/kg
La quantité utile est quasiment inchangée :
wutile=731,31-366,02-(231,55+9,87)=123,87kJ/kg
Le rendement est assez fortement augmenté :
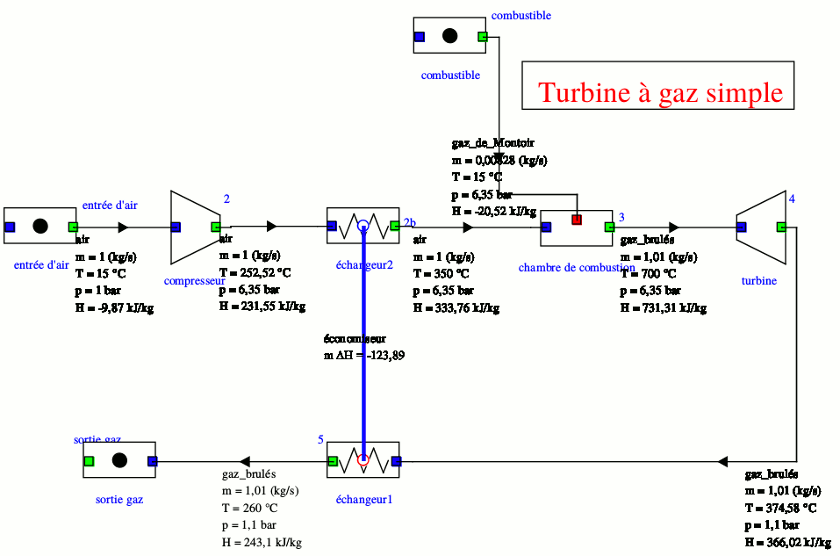
Merci pour vos réponse cela ma grandement aidée puisque j'ai enfin terminé avec cet exercice 😂
J'ai a présent un nouveau problème, je sens que je ne suis pas loin mais je dois me tromper dans mes hypothèses... voici l'énoncé:
Soit 1kg de glace à -15°C. On veut faire passer la glace a l'état de vapeur d'eau, à Patm. Quelle quantité d'énergie thermique faut-il fournir?
Données:
*capacité thermique massique de la glace= 2,1 kJ/kg/K
*capacité thermique massique de l'eau liquide= 4,2 kJ/kg/K
*enthalpie de fusion= 334 kJ/kg
*enthalpie de vaporisation= 2256kJ/kg
J'ai donc séparer cette transformation en 3 étapes:
1) glace (-15°C) à glace (0°C)
2) glace (0°C) à eau (0°C)
3) eau (0°C) à vapeur (100°C)
Ensuite j'ai trouver ces résultats:
L1= mCm(T2-T1) = 1×2,1×(0-(-15))= 31,5kJ
L2=1*2,1*(0-0)=0
L3=1×4,2×(100-0)= 420kJ
Donc l'énergie totale est L1+L2+L3 = 451,5 kJ
Mais ces résultats me semblent bizarres, en effet pour L2 j'obtiens 0 mais je suis persuadee que ce ne sont pas les bonnes valeurs.
Pourriez vous éclairer ma lanterne ? 🙂 merci
Bonjour
Pour une meilleure lisibilité du forum, il aurait été préférable de créer un nouveau topic puisque cet exercice est indépendant du premier mais je vais tout de même te répondre bien volontiers.
Remarque préliminaire : puisque le transfert d'énergie thermique s'effectue à pression extérieure fixe, ce transfert correspond à une variation d'enthalpie. Puisque l'enthalpie est une fonction d'état, il est possible de faire le calcul en imaginant un certain nombre d'étapes simples. En revanche, je crains que tu n'ais pas bien compris la notion d'enthalpie massique de changement d'état.
étape 1 : réchauffement de la glace de -15°C à 0°C :  H1=31,5kJ : OK
H1=31,5kJ : OK
étape 2 : fusion de la glace à température fixe (0°C) :  H2=m.
H2=m. Hfusion=1*334=334kJ
Hfusion=1*334=334kJ
étape 3 : échauffement du liquide de 0°C à 100°C :  H3=420kJ
H3=420kJ
étape 4 : vaporisation du liquide à température fixe (100°C) :  H4=m.
H4=m. Hvaporisation=1*2256=2256kJ
Hvaporisation=1*2256=2256kJ
Reste à faire la somme. A noter que le terme prépondérant correspond à la vaporisation.
Merci beaucoup, j'ai encore beaucoup d'autre questions, je suis entrain de refaire tout mes exercice pour me remettre à niveau mais du coup il y en a beaucoup que je ne comprend pas 😂
Re bonjour Vanoise,
Il semble que j'ai du mal à comprendre les hypothèses, par exemple sur l'exercice de la glace juste au dessus la prof ma dot qu'il fallais faire 5 hypothèse, donc j'ai donner:
Pas de pertes thermiques
Si dT est faible alors Cp est constante mais je n'en voit pas d autre 😂
A mon avis, la principale, dont j'ai parlée dans mon message sur le sujet, concerne le fait que l'évolution se fait de façon isobare (à pression constante) ou monobare (sous pression extérieure constante). Cela permet de poser Q= H et comme H est une fonction d'état, on peut décomposer l'évolution en différentes étapes fictives simples.
H et comme H est une fonction d'état, on peut décomposer l'évolution en différentes étapes fictives simples.
La valeur de  Hfusion correspond à une fusion à 0°C sous 1atm ;
Hfusion correspond à une fusion à 0°C sous 1atm ;
La valeur de  Hvaporisation correspond à une vaporisation à 100°C sous 1atm.
Hvaporisation correspond à une vaporisation à 100°C sous 1atm.
Les capacités thermiques massiques isobares sont considérées comme indépendantes de T...


 guide latex
guide latex présent sous la zone de saisie du message. La liste complète des caractères mathématiques est disponible dans le
présent sous la zone de saisie du message. La liste complète des caractères mathématiques est disponible dans le  mode d'emploi du forum
mode d'emploi du forum
