Inscription / Connexion Nouveau Sujet
Problème : dimérisation du perchlorure de fer (III)
 etudiantilois
etudiantiloisBonsoir,
J'ai un problème à faire pendant ces vacances de Noël que je trouve difficile.
***Où est la contextualisation du problème : quel est le thème/chapitre abordé, le but du problème, etc. ?***
Le professeur a conseillé de commencer par la partie B car c'est du programme de deuxième année, contrairement aux autres parties qui sont du programme de première année.
Pour la partie B, donc, à la première question, on nous demande si le système est à l'équilibre thermodynamique : quelle est la méthode pour cela ? Comparer le quotient de réaction à la constante d'équilibre ? Mais comment calculer le quotient de réaction dans notre cas ?
Voici l'énoncé en PDF car il fait plus d'une page :![]()
Merci beaucoup par avance pour votre aide et joyeuses fêtes de fin d'année.
***Titre complété (cela fait partie de la contextualisation demandée dans la dérogation à la règle ...)***
Bonjour,
Il faudrait que l'on comprenne pourquoi vous n'arrivez-vous pas à calculer Q.
Comment s'exprime Q ici ?
Bonsoir,
Merci pour votre réponse.
Finalement, après des recherches et avec mon cours, j'ai réussi les questions suivantes : B1, B3, B4, et B5.
Je bloque à la question B2 : comment peut-on savoir si c'est exothermique ou endothermique avant de connaître  rH° ? Je bloque aussi pour B6. Je pense qu'il faut utiliser la loi de Le Chatelier... Mais quoi dire concrètement ?
rH° ? Je bloque aussi pour B6. Je pense qu'il faut utiliser la loi de Le Chatelier... Mais quoi dire concrètement ?
Merci beaucoup pour votre aide.
Bonjour,
Pour B2, vous connaissez K à deux températures différentes, que savez-vous de K(T) ?
Pour B6, il y a différentes techniques, on peut faire calculatoire simple : appelez nN la quantité de matière de N2, calculez la nouvelle valeur du quotient/produit de réaction, comment évolue celui-ci ? comment évolue  G ? On peut aussi faire à partir de loi qualitative : ici on a un effet de dilution (N2 inerte), donc ?
G ? On peut aussi faire à partir de loi qualitative : ici on a un effet de dilution (N2 inerte), donc ?
Pour B2, vous connaissez K à deux températures différentes, que savez-vous de K(T) ?
Je ne vois pas où vous voulez en venir... On sait seulement que K(T) dépend de la température ?
Pour B6, je pense que c'est la loi qualitative de Le Châtelier qu'il faut utiliser. Je me suis renseigné ici :
Merci beaucoup de m'aider !
@vanoise : Pensez-vous, en l'absence de gts2, pouvoir m'aider sur cet exercice ?
J'aimerais vraiment finir cette partie B d'ici ce soir, car il me reste encore énormément de devoirs à faire pour la rentrée...
Merci beaucoup pour votre aide par à avance.
Bonjour gts2,Bonjouretudiantilois
Je laisse gts2 gérer ce post. Juste un petit "dépannage" pour faire gagner du temps à etudiantilois.
Pour B2 : l'énoncé précise que la constante d'équilibre décroit en fonction de T. Sans calcul, la loi de Van t'Hoff donne le signe de l'enthalpie standard de réaction. Si besoin, voir ici paragraphe II.8.a page 15 : ![]() .
.
Pour B6 : la méthode proposée par gts2 convient. On peut déterminer l'influence de l'ajout d'azote sur le quotient Qr de réaction et comparer la nouvelle valeur à la constante d'équilibre K°, ce qui revient à obtenir le signe de l'affinité chimique A=- r G.
r G.
Il y un peu plus simple : l'ajout du gaz inerte à T fixe et pression totale fixe revient à diminuer la somme des pressions partiels des gaz actifs. L'influence de cet ajout est qualitativement la même que celle d'une baisse isotherme de pression en absence de diazote.
Bonjour,
Pour K(T), vous avez votre réponse.
Pour B6 : il y a "36" moyens, je vous avez suggéré "dilution", donc loi de modération on "concentre", donc il faut augmenter la quantité de gaz.
Merci beaucoup à vous 2 pour vos réponses.
B2 : Loi de Van't Hoff : d(lnK)/dT= rH°/RT2
rH°/RT2
La constante d'équilibre décroit en fonction de T.
Donc : d(lnK)/dT<0
Donc comme RT>0, alors smb]deltamaj[/smb]rH°<0.
Est-ce que tout est correct dans ce raisonnement ?
B6 : D'après le site Internet donné au-dessus, on aurait donc un déplacement de l'équilibre dans le sens d'une augmentation de la pression du système, c'est à dire dans le sens d'une augmentation du nombre de moles de composés gazeux du système.
Est-ce bien ça ? Mais comment savoir si le système est toujours à l'équilibre ?
Merci encore.
Bonjour,
Oui c'est bien cela.
Pour montrer que le système n'est plus à l'équilibre, soit vous utilisez la loi de modération "à l'envers" : si le système doit évoluer pour trouver l'équilibre c'est qu'il ne l'était plus !
Sinon technique calculatoire : à T constante (donc K constant), vous calculer Q qui est modifié, donc le système n'est plus à l'équilibre.
Pour la B2 c'est donc le raisonnement attendu ?
Et qu'appelez-vous "loi de modération" ? Ça correspond à la loi de Le Châtelier ?
Merci encore.
Oui c'est bien cela loi de modération ou loi de Le Châtelier
L'avantage de la deuxième est qu'elle permet d'introduire un peu d'histoire des sciences, de la première est que le nom même donne le contenu.
Pour B2, c'est bien cela.
Merci beaucoup pour votre réponse.
Pour la B2, j'ai donc bien compris.
Par contre, je ne suis vraiment pas sûr d'avoir compris le raisonnement.
Pourriez-vous récapituler le raisonnement à avoir s'il vous plaît ?
Sachant que la seule formulation de la loi de Le Châtelier que j'ai dans mon cours est : une élévation de pression isotherme entraîne un déplacement ou une rupture de l'équilibre dans le sens d'une diminution de la quantité de matière gazeuse.
Pourquoi aurait-on une "élévation de pression isotherme" à la question B6 ?
Merci beaucoup pour votre temps.
Par contre, je ne suis vraiment pas sûr d'avoir compris le raisonnement.
Pourriez-vous récapituler le raisonnement à avoir s'il vous plaît ?
Je parle du raisonnement attendu à la question B6.
Merci encore.
Il y un peu plus simple : l'ajout du gaz inerte à T fixe et pression totale fixe revient à diminuer la somme des pressions partiels des gaz actifs. L'influence de cet ajout est qualitativement la même que celle d'une baisse isotherme de pression en absence de diazote.
@vanoise : Comment savez-vous tout cela ?
Merci.
À l'équilibre, avant l'ajout de diazote, la somme des pressions partielles des deux gaz actifs est P, la pression totale. Juste après l'ajout de diazote, la somme précédente devient :
(P - PN2).
Or seuls les pressions des gaz actifs interviennent dans l'expression du quotient de réaction.
Donc, pour les gaz actifs, et pour le calcul du quotient de réaction tout se passe comme si la pression avait diminué sans ajout de N2.
Mais le calcul de Qr n'est pas nécessaire. La loi de modération de Le Chatelier donne le résultat attendu.
Merci beaucoup pour votre réponse.
Il y a maintenant uniquement ceci que je ne comprends pas :
Juste après l'ajout de diazote, la somme précédente devient :
(P - PN2).
Pourquoi ?
Ensuite, la seule formulation de la loi de Le Châtelier que j'ai dans mon cours est : une élévation de pression isotherme entraîne un déplacement ou une rupture de l'équilibre dans le sens d'une diminution de la quantité de matière gazeuse.
Alors comment peut-on savoir ce qu'il se passe dans le cas d'une diminution de pression isotherme, puisque c'est le cas ici d'après ce que vous me dites vanoise ?
Merci encore.
Bonsoir,
On travaille à P=P0 constante, donc avant introduction de N2
P0=P (réactifs et produits), et après
P0=PN2+P (réactifs et produits)
Quasi toutes les lois physiques sont algébriques, dont la loi de Le Chatelier.
Une diminution entraîne un déplacement dans le sens inverse de celui produit par une augmentation. Logique puisque, comme déjà précisé par gts2, la loi de Le Chatelier est une loi de modération. À titre approfondissement, tu peux lire le document que je t'ai fourni sur les lois de modération.
Merci beaucoup, tout ceci est bien plus clair !
Pour la partie II :
Les questions 1 à 4 sont simples.
Par contre, à la question 5, à quoi correspondent C1, C2, C3 ? Je ne vois vraiment pas comment les calculer... Pourtant j'ai revu le cours sur les titrages...
Merci encore de m'aider.
Bonjour,
Vous avez trois espèces à doser donc il y aura trois points remarquables dans vos courbes, pour laquelle vous appliquerez les techniques usuelles à l'équivalence.
Si vous n'avez fait jusqu'à présent que des dosages simples, il faut considérer qu'il y a des dosages successifs et vous êtes alors ramené au cas connu. (Attention au "piège" : le volume à prendre en compte pour la 2ème équivalence est ve2-ve1).
Il reste à savoir quelle équivalence prendre pour quelle espèce : plusieurs possibilités, vous déterminez la réaction prépondérante, cela sera la 1ère équivalence, vous faites le dosage de cette espèce et vous recommencez. Autre possibilité, vous connaissez des points remarquables sur une courbe pH(v), repérez les valeurs correspondantes. Enfin comme il y a un dosage par précipitation, la courbe de dosage n'a pas la même allure donc elle est facilement repérable.
Merci beaucoup pour votre réponse.
Ce que je ne comprends pas, c'est comment on peut déterminer la réaction prépondérante ?
Je suis vraiment perdu, j'avais l'habitude des dosages simples, mais là je ne comprends vraiment plus rien avec le mélange...
Merci beaucoup de m'aider.
Il y a deux choses : d'une part les deux acides, là c'est facile il y a un fort et un faible, donc la soude va d'abord agir sur le fort puis le faible. Calculer éventuellement les deux constantes d'équilibre des équations de dosage, mais la règle base la plus forte sur acide le plus fort doit suffire.
Il reste le précipité, le plus simple est de calculer le pH de début de précipitation pour positionner le dosage de Mg2+
Il faut donc construire une échelle de pKa ?
Une fois qu'on a la réaction prépondérante, que faut-il faire ?
Et ensuite ? En fait, quels sont les 3 titrages successifs ? Sachant que j'ai deux sauts de pH alors qu'on demande 3 concentrations... Ça me perturbe beaucoup.
Merci, grâce à vous je commence à mieux comprendre !
Bonjour,
On fait disons le premier dosage HCl / NaOH en "oubliant" les autres espèces, on va jusqu'à l'équivalence 0,1*10=0,2*Ve soit 5 mL. On a alors en solution Mg2+ CH3COOH et on peut maintenant "oublier" HCl. On calcule disons le pH à demi-équivalence pour l'acide et le pH de précipitation de Mg(OH)2, on trouve que le premier est inférieur au second. On a donc pour le deuxième dosage CH3COOH / NaOH.
La courbe ressemble à la simulation jointe, pour laquelle on a bien trois équivalences.
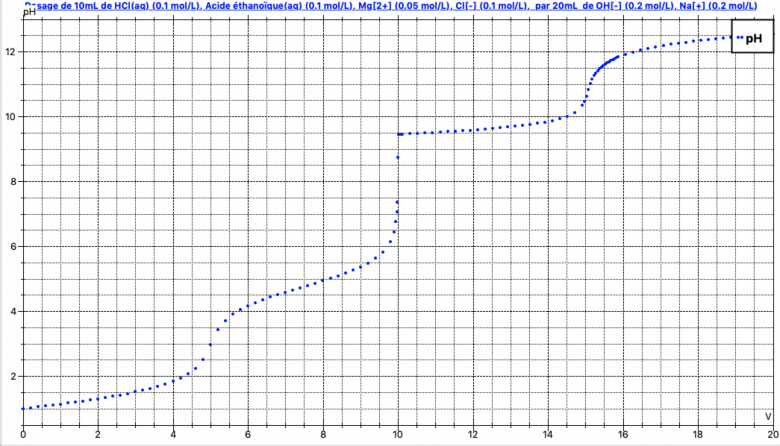
Je suis vraiment désolé mais je ne comprends vraiment rien à partir de là :
On calcule disons le pH à demi-équivalence pour l'acide et le pH de précipitation de Mg(OH)2, on trouve que le premier est inférieur au second. On a donc pour le deuxième dosage CH3COOH / NaOH.
Pourquoi devrait-on calculer le pH ? Et comment ?
C'est quoi un pH de précipitation ?
Encore désolé de ne pas comprendre...
Bonjour,
Il s'agit de savoir si on a d'abord HO- + CH3COOH -> ou Mg2+ + HO- ->
Donc comme on n'est pas dans le cas classique de comparaison de deux couples acide-base ou redox, il faut trouver une autre solution. Ceci étant, visuellement vous avez du voir sur la simulation que cela se voit sur la courbe, et expérimentalement, cela sera encore plus simple, vous verrez bien quand le précipité va se former. Donc l'étude suivante est inutile si vous faites le dosage ou si vous avez une courbe à votre disposition.
Le pH à demi-équivalence est classiquement pKa=, et là je m'aperçois que l'on ne le connait pas puisqu'il s'agit de le déterminer ! On va quand même terminer pKa=4,75, d'autre part Mg2+ commence à précipiter quand le produit (Mg2+)(HO-)2 atteint Ks, on calcule le pH correspondant, je trouve pH=8, donc comme le pH augmente, on fera le dosage acide-base avant le dosage de précipitation.
Donc à la question "pourquoi devrait-on calculer le pH ?", il n'est pas nécessaire de calculer le pH en TP, le choix des trois équivalences devrait être clair. Le calcul du pH n'est nécessaire que si on veut prédire avant le TP ce qui va se passer ou si on veut décrire ce qui se passe sur une feuille de papier ou sur Internet sans support expérimental.
Donc votre compréhension progressera lorsque vous ferez le TP.
Bonjour,
Une remarque : j'ai cru comprendre que d'après les règles du forum, vous auriez ouvrir une nouvelle discussion. Si le dernier message est suffisant, très bien, sinon cela serait peut-être à faire.
Merci beaucoup pour votre réponse.
Effectivement, je vais ouvrir un nouveau post car tout cela ne me semble vraiment pas clair. J'ai fait le TP le lundi avant les vacances, et je ne me souviens pas du tout de ce qu'il s'est passé. J'en suis désolé.
En attendant que je crée le nouveau topic (je le fais dans 2h environ, je suis débordé), si vous avez une idée pour reprendre tout ce TP du début, ce serait formidable.
Un grand merci pour votre temps. Cela m'inquiète car ça peut tomber au concours...


