Inscription / Connexion Nouveau Sujet
Problème de dosage
Bonjour à tous,
Je suis sur un tp de chimie dans lequel on a une partie avec beaucoup de dosages et je me perds un peu. Je vous donne l'énoncé ci dessous
Dosage colorimétrique de l'oxalate de fer (II) par la solution de permanganate de potassium
Principe : ce dosage comporte deux parties.
Dans la première partie, on dose à la fois les ions fer(II) et oxalate par la solution de permanganate de potassium.
Dans la seconde partie, on réduit par le zinc les cations fer(III) formés dans la première partie. La réduction terminée, les cations fer(II) régénérés sont à nouveau dosés par le permanganate.
Dans un erlenmeyer, dissoudre au maximum 0,12 g d'oxalate de fer(II) dans 25 mL d'acide sulfurique à 2 mol.L-1.
Doser par la solution de permanganate de potassium placée dans la burette.
Quand la couleur du permanganate est lente à disparaître, chauffer la solution vers 60°C et poursuivre le dosage.
Relever le volume V1 utilisé.
Sous la hotte, ajouter doucement à cette solution environ 1 g de poudre de zinc.
Laisser réagir 15 minutes en agitant doucement.
Pour éliminer le zinc surnageant, filtrer la solution sur un entonnoir avec un petit tampon de laine de verre.
La filtration terminée, bien rincer l'erlenmeyer, l'entonnoir et son tampon de laine de verre en récupérant les eaux de lavage dans l'erlenmeyer de dosage (les rinçages sont faits plusieurs fois avec des petites quantité d'eau déionisée).
Ajouter 10 mL d'acide sulfurique à 2 mol.L-1.
Doser par la solution de permanganate de potassium et relever le volume V2.
1)Ecrire l'équation de dissolution du complexe.
2)Ecrire les équations des réactions qui se produisent lors de l'ajout du volume V1 de 3)permanganate. Quelle espèce est oxydée par le permanganate en premier
4)Ecrire l'équation de la réaction ayant lieu quand on ajoute du zinc.
5)Pourquoi est-ce important de filtrer avant de doser par la solution de permanganate ?
6)Quelle réaction se produit lors de l'ajout du volume V2 de permanganate ?
7)Indiquer les masses d'oxalate de fer (II) pesées, les volumes V1 et V2 de solution à l'équivalence.
Pour la question 6) s'agit il de MnO4- + 5Fe2+ +8H+ => 5Fe3+ +Mn2+ + 4H20 ?
Il me semble que c'est aussi ce qu'il se passe pour l'ajout de V1 en question 2 (sans prendre en compte l'acide oxalique). J'ai un doute : ça vous paraît bon ?
Les deux volumes équivalents que j'ai trouvé sont très différents.
Merci d'avance pour l'aide accordé.
Ps : Si il manque des infos je peux vous les donner.
Bonsoir
Oui à ta question sur la réaction 6
Première expérience : les ions permanganates dosent à la fois les ions fer(II) et les ions oxalate ; deuxième expérience : les ions permanganate dosent uniquement les ions fer(II) : V1 doit être nettement supérieur à V2.
D'accord merci.
J'ai une autre question:
On me demande quelle espèce est oxydé en premier par le permanganate.
J'imagine en vu des potentiels redox standard des couples données ci dessous qu'il s'agit du fer?
E°(MnO4-/Mn2+) = 1,51 V ; E°(CO2/H2C2O4) = -0,49 V ; E°(Fe3+/ Fe2+) = 0,77 V
Mais du coup le volume à l'équivalence V1 (18,4ml) je ne comprends pas comment il peut titrer à la fois les ions fer et acide oxalique. A quoi correspond-ils donc??
Bonne soirée (ou bon dimanche) en fonction de quand vous lirais.
Les écarts de potentiels standard sont suffisamment grands pour que les deux réactions puissent être considérées comme quasi totales. Les ions permanganate vont donc oxyder à la fois les ions fer II et l'acide oxalique. Il y a cependant une différence importante entre les deux réactions du point de vue cinétique. La réduction des ions fer II utilise comme réactifs des ions de charges électriques opposées qui s'attirent électriquement, ce qui rend la vitesse de réaction importante. La réduction de l'acide oxalique utilise comme réactifs des ions négatifs et des molécules. La vitesse de réaction est donc nettement plus faible.
On me demande quelle espèce est oxydé en premier par le permanganate.
J'ai expliqué pourquoi la réaction avec les ions fer est du point de vue cinétique plus rapide que celle avec l'acide oxalique mais, réflexion faite, je ne pense pas qu'il s'agisse de la réponse souhaitée ici. Comme en pHmétrie, quand tu dois doser par la soude un mélange de plusieurs acides, il faut prendre en compte les constantes d'équilibre des réactions de dosages. Ici, les écarts de potentiels standard sont importants pour les deux réactions : les deux réactions seront donc totales. Cependant, l'écart de potentiels est nettement plus grand pour la réaction de réduction de l'acide oxalique. La constante d'équilibre de la réaction de réduction de l'acide oxalique est donc nettement supérieure à la constante d'équilibre de la réaction de réduction des ions fer(II). Conséquence : les deux réactions de réduction seront en fait successives : d'abord la réduction de l'acide oxalique puis la réduction des ions fer(II).
Mais du coup le volume à l'équivalence V1 (18,4ml) je ne comprends pas comment il peut titrer à la fois les ions fer et acide oxalique. A quoi correspond-ils donc??
L'énoncé précise que le dosage est colorimétrique ; cela est possible sachant que les ions permanganate ont une couleur rose-violet et que toutes les autres espèces, en milieu acide, sont incolores. Quand tu ajoutes progressivement à l'aide d'une burette,la solution de permanganate de potassium dans le mélange contenant l'acide oxalique et les ions fer(II), la coloration violette disparaît au fur et à mesure de l'ajout tant que les ions permanganate réagissent en se transformant en ions manganèse incolores. Lorsque les ions permanganate ont oxydé la totalité de l'acide oxalique et la totalité des ions fer(II), les ions permanganate restent dans le bécher sans réagir : la solution devient rose-violet. Le volume V1 de solution de permanganate de potassium ajouté correspond donc à l'apparition de la coloration rose-violet et donc à la réduction totale de l'acide oxalique et des ions fer(II).
Pour la seconde expérience : les ions fer(II) de la première expérience ont été régénérés grâce au zinc mais il n'y a plus d'acide oxalique. Le volume V2 sert à doser uniquement les ions fer(II). Le volume nécessaire à la réduction de l'acide oxalique est donc le volume (V1-V2).
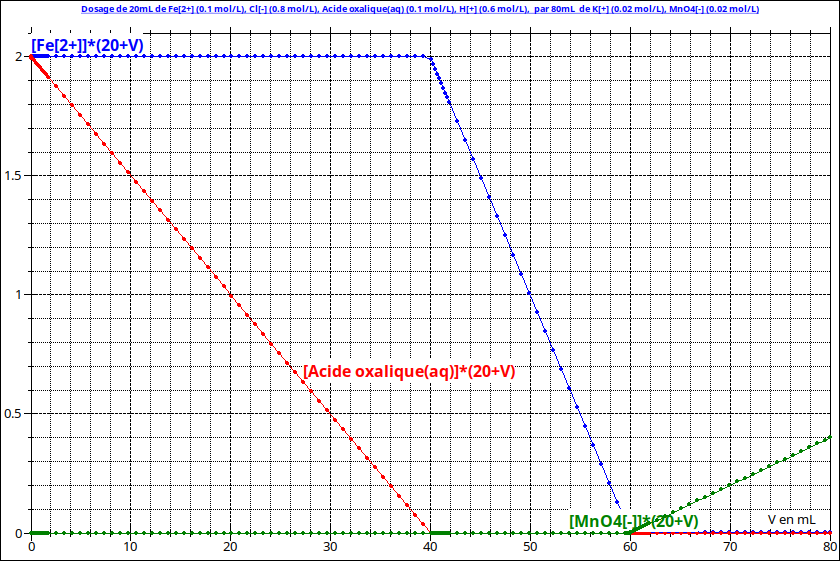
Pour t'aider à comprendre, voici une simulation du dosage avec des valeurs totalement arbitraires mais l'allure des courbe peut t'aider. Sont représentées trois courbes correspondant aux variations de quantités dans la solution en fonction du volume de solution de KMnO4 ajouté.
Pour V<40mL : la quantité d'acide oxalique diminue, celle d'ions fer(II) reste constante : il y a bien réduction de l'acide oxalique seulement.
Pour 40mL<V<60mL : il n'y a plus d'acide oxalique et la quantité d'ions fer(ii) diminue : il y a réduction des ions fer(II). Cela prouve bien que les deux réductions sont successives.
Pour V>60mL : les réactions de réduction sont terminées. Les ions permanganate ajoutés restent en solution : leur quantité en solution augmente.
Pour les réactions successives penses tu qu'il faut que je calcul la constante d'équilibre pour montrer la "prédominance" d'une réaction sur l'autre?
Je ne suis pas sur d'avoir toutes les données pour le faire.
Vue le contexte : dosage colorimétrique et non potentiométrique, il n'est sans doute pas indispensable de calculer les deux constantes d'équilibre.
Pour info : on considère en général les deux réactions comme successives et indépendante quand le rapport des deux constantes est au moins égal à 104. La condition est largement vérifiée ici.


